SALUD PUBLICA -
PAUTAS PARA LA ATENCION AL PACIENTE INFECTADO CON
TRYPANOSOMA CRUZI - APROBACION
Resolución (MS) 1337/14.
Del 15/8/2014. B.O.: 25/8/2014. Apruébanse las PAUTAS PARA LA ATENCION
AL PACIENTE INFECTADO CON TRYPANOSOMA CRUZI (ENFERMEDAD DE CHAGAS).
Bs. As., 15/8/2014
VISTO el Expediente N° 1-2095-S01:0001843/2012 del registro de la
ADMINISTRACION NACIONAL DE LABORATORIOS E INSTITUTOS DE SALUD “DR.
CARLOS G. MALBRÁN” (ANLIS), y
CONSIDERANDO:
Que las políticas de salud tienen por objeto primero y prioritario
asegurar el acceso de todos los habitantes de la Nación a los Servicios
de Salud, entendiendo por tales al conjunto de los recursos y acciones
de carácter promocional, preventivo, asistencial y de rehabilitación,
sean éstos de carácter público estatal, no estatal o privados; con
fuerte énfasis en el primer nivel de atención.
Que en el marco de las políticas del MINISTERIO DE SALUD se desarrolla
el PROGRAMA NACIONAL DE GARANTIA DE CALIDAD DE LA ATENCION MEDICA, en el
cual se agrupan un conjunto de acciones destinadas a asegurar la calidad
de las prestaciones en dichos servicios.
Que entre dichas acciones se encuentran la elaboración de guías de
diagnóstico, tratamiento y procedimiento de patologías y Directrices de
organización y funcionamiento de los Servicios de Salud.
Que las citadas Pautas para guías y Directrices se elaboran con la
participación de entidades Académicas, Universitarias y Científicas de
profesionales asegurando de esa forma la participación de todas las
áreas involucradas en el Sector Salud.
Que entre dichas acciones se encuentran la elaboración de Guía, de
Pautas de diagnóstico, tratamiento y procedimientos para el abordaje de
patologías prioritarias para nuestro país.
Que la presente Pauta para la Atención al Paciente Infectado con
Trypanosoma Cruzi (Enfermedad de Chagas) ha sido elaborada con la
participación de Entidades científicas, Académicas y Deontológicas que
se detallan a continuación: SOCIEDAD DE OBSTETRICIA Y GINECOLOGIA DE
BUENOS AIRES, PLAN NACIONAL DE SANGRE, SOCIEDAD ARGENTINA DE
INFECTOLOGIA, SOCIEDAD ARGENTINA DE PEDIATRIA, FEDERACION ARGENTINA DE
CARDIOLOGIA, SOCIEDAD ARGENTINA DE COLOPROTOCLOGIA, DEPARTAMENTO DE
MICROBIOLOGIA, PARASITOLOGIA E INMUNOLOGIA DE LA FACULTAD DE MEDICINA DE
LA UBA, FEDERACION ARGENTINA DE MEDICINA GENERAL y el CENTRO NACIONAL DE
GENETICA MEDICA - ANLIS “DR. CARLOS G. MALBRÁN”.
Que la SUBSECRETARIA DE POLITICAS, REGULACION Y FISCALIZACION,
Coordinadora General del PROGRAMA NACIONAL DE GARANTIA DE CALIDAD DE LA
ATENCION MEDICA, Y LA SECRETARIA DE POLITICAS, REGULACION E INSTITUTOS
han tomado intervención y avalan su incorporación al PROGRAMA NACIONAL
DE GARANTIA DE CALIDAD DE LA ATENCION MEDICA.
Que la DIRECCION GENERAL DE ASUNTOS JURIDICOS ha tomado la intervención
de su competencia.
Que la presente medida se adopta en uso de las atribuciones contenidas
por la “Ley de Ministerios T.O. 1992”, modificada por Ley N° 26.338.
Por ello,
EL MINISTRO DE SALUD
RESUELVE:
ARTICULO 1° — Apruébanse las PAUTAS PARA LA ATENCION AL PACIENTE
INFECTADO CON TRYPANOSOMA CRUZI (ENFERMEDAD DE CHAGAS), que como ANEXO,
forma parte integrante de la presente Resolución.
ARTICULO 2° — Incorpóranse al PROGRAMA NACIONAL DE GARANTIA DE CALIDAD
DE LA ATENCION MEDICA las PAUTAS PARA LA ATENCION AL PACIENTE INFECTADO
CON TRYPANOSOMA CRUZI (ENFERMEDAD DE CHAGAS).
ARTICULO 3° — Invítase a las Autoridades Sanitarias Jurisdiccionales y
Entidades Académicas, Universitarias y Científicas Profesionales a
efectuar observaciones dentro de un plazo de SESENTA (60) días a partir
de la fecha de su publicación en el Boletín Oficial.
ARTICULO 4º — En el caso que la Autoridad jurisdiccional realizara
alguna adecuación a la presente Directriz para su aplicación a nivel de
la Jurisdicción deberá comunicar a la Coordinadora General del PROGRAMA
NACIONAL DE GARANTIA DE CALIDAD DE LA ATENCION MEDICA, dicha adecuación,
la que recién entrará en vigencia a los SESENTA (60) días de su registro
a nivel nacional a través del acto administrativo correspondiente.
ARTICULO 5º — Agradecer a las ENTIDADES Participantes, ADMINISTRACION
NACIONAL DE LABORATORIOS E INSTITUTOS DE SALUD (ANLIS) “DR. CARLOS G.
MALBRÁN”, INSTITUTO NACIONAL DE PARASITOLOGIA “DR. MARIO FATALA CHABEN”,
y al CENTRO NACIONAL DE DIAGNOSTICO E INVESTIGACION DE ENDEMOEPIDEMIAS (CENDIE),
la importante colaboración brindada a este Ministerio.
ARTICULO 6º — Regístrese, comuníquese, publíquese, dése a la Dirección
Nacional del Registro Oficial y archívese.
PAUTAS PARA LA ATENCION AL PACIENTE
INFECTADO CON Trypanosoma cruzi
(Enfermedad de Chagas)
Ministerio de Salud de la Nación
Secretaría de Políticas, Regulación e Institutos
Administración Nacional de Laboratorios e Institutos de Salud
(ANLIS) “Dr. Carlos G. Malbrán”
Instituto Nacional de Parasitología “Dr. Mario Fatala Chabén”
Centro Nacional de Diagnóstico e Investigación de Endemoepidemias (CeNDIE)
Secretaría de Promoción y Programas Sanitarios
Subsecretaría de Prevención y Control de Riesgos
Dirección de Enfermedades Transmisibles por Vectores
Programa Nacional de Chagas
Agosto de 2012
Revisión Noviembre 2011 - Julio 2012
(Resolución Ministerial en trámite)

Coordinación de la edición
Instituto Nacional de Parasitología “Dr. Mario Fatala Chabén”, Avda.
Paseo Colón 568 (1063), Buenos Aires, Argentina, Tel. (54-11) 4331-7732,
Fax 4331-7142, fatala@anlis.gov.ar. Centro Nacional de Diagnóstico e
Investigación de Endemoepidemias (CeNDIE), Tel/Fax (54-11) 4331-7732,
cendie@anlis.gov.ar, Administración Nacional de Laboratorios e
Institutos de Salud (ANLIS) “Dr. Carlos G. Malbrán”.
Programa Nacional de Chagas, Dirección de Enfermedades Transmisibles por
Vectores, Subsecretaría de Prevención y Control de Riesgos, Secretaría
de Promoción y Programas Sanitarios, Av. 9 de Julio 1925 (1073), Buenos
Aires, Argentina, Tel. (54-11) 4379-9193, diretv@msal.gov.ar
Citación sugerida:
Pautas para la atención al paciente infectado con Trypanosoma cruzi
(Enfermedad de Chagas). Buenos Aires: Ministerio de Salud de la Nación,
2012.
CONTENIDO
1. INTRODUCCION
2. PARASITO, VECTOR Y FORMAS DE TRANSMISION
3. FASES DE LA INFECCION POR T. cruzi
3.1 Fase aguda
3.1.1 Concepto
3.1.2 Evaluación de la vía de transmisión
3.1.3 Diagnóstico de la infección aguda por T. cruzi
3.1.4 Evaluación general del paciente y tratamiento
3.1.5 Enfermedad aguda vectorial
3.1.6 Chagas congénito
3.1.7 Pacientes inmunocomprometidos
3.1.8 Enfermedad de Chagas postransfusional
3.1.9 Accidentes de trabajo con material contaminado con T. cruzi
3.2 Fase crónica
3.2.1 Concepto
3.2.2 Diagnóstico de fase crónica
3.2.3 Evaluación inicial de la persona con infección crónica
3.2.4 Fase crónica, forma sin patología demostrada
3.2.5 Fase crónica, forma con patología demostrada
4. TRATAMIENTO ETIOLOGICO TRIPANOCIDA
4.1.1 Indicaciones del tratamiento tripanocida
4.1.2 Drogas tripanocidas
4.1.3 Administración y supervisión del tratamiento
4.1.4 Efectos adversos y su manejo
4.1.5 Controles posterapéuticos
5. ACCIONES PREVENTIVAS SANITARIAS
5.1.1 Vigilancia epidemiológica
5.1.2 Vigilancia farmacológica
5.1.3 Control de donantes en bancos de sangre y/o servicios de
hemoterapia
5.1.4 Orientación laboral
6. REFERENCIAS
7. ANEXO I. Historia clínica del paciente infectado por T. cruzi con
tratamiento tripanocida
8. ANEXO II. Manejo de la lesión visceral cardiológica por Enfermedad de
Chagas
9. ANEXO III. Eventos adversos más frecuentes o graves con el uso de
benznidazol o nifurtimox
10. INSTITUCIONES COORDINADORAS
11. ORGANIZACIONES PARTICIPANTES
Desde 1993 el Programa Nacional de Chagas ha implementado una nueva
estrategia para el control de la Enfermedad de Chagas con base en la
participación comunitaria, (Chuit R 1992, Segura EL 2000) así como la
identificación de dos grandes líneas,
a- acciones vectoriales: rociado de la unidad domiciliaria y vigilancia
entomológica.
b- no vectoriales: la atención de pacientes con infección aguda
(congénito, vectorial, transfusional) y pacientes con infección crónica.
Dicha estrategia ha sido consolidada en el año 2010 con la aprobación
del “Plan 2011-2016 para el control de la Enfermedad de Chagas en la
Argentina (Boletín Oficial 32.426, Res. 867/12) (Ministerio de Salud
2010).
En el marco de las actividades de control no vectorial de la Enfermedad
de Chagas, se han elaborado las “Guías para la Atención del Paciente
Infectado por Trypanosoma cruzi”, aprobadas por resolución ministerial
N° 1870 en noviembre de 2006 (Ministerio de Salud 2006). El presente
documento actualiza y reemplaza dichas Guía, tomando en consideración
resultados de investigaciones clínicas recientes y recomendaciones de
expertos. Además, se ha reemplazado la denominación de la “forma
indeterminada” de la fase crónica por el término “sin patología
demostrada”. A continuación se resume el alcance de la presente guía.
Objetivo general: Delinear las recomendaciones para la atención médica
de niños, adolescentes y adultos infectados por el T. cruzi, en
cualquiera de sus fases y formas clínicas. Se espera de esta forma
optimizar el uso de recursos y mejorar la calidad de atención de los
pacientes, con el fin de aumentar el número de personas diagnosticadas,
controladas y tratadas, y contribuir a disminuir la morbimortalidad y la
transmisión de la Enfermedad de Chagas en la Argentina.
Destinatarios: Las presentes pautas están dirigidas a todos los agentes
de salud, médicos generalistas, de familia, clínicos, pediatras,
neonatólogos, obstetras, cardiólogos, infectólogos, gastroenterólogos y
todo personal de salud que tenga a su cuidado personas infectadas por T.
cruzi de cualquier edad y sexo en todo el ámbito del Territorio
Nacional.
Población diana: pacientes infectados por T. cruzi de cualquier edad y
sexo, asistidos en cualquier centro de salud de la República Argentina.
Aspectos cubiertos por estas pautas:
• Breve descripción del parásito, vector y formas de transmisión.
• Recomendaciones relativas a la evaluación clínica, diagnóstico y
exámenes complementarios a aplicar en los pacientes con las distintas
fases de la infección por T. cruzi:
- Fase aguda adquirida por vía vectorial, transplacentaria,
transfusional, trasplante de órganos, accidente laboral y reactivaciones
en inmunocomprometidos.
- Fase crónica, forma sin patología demostrada
- Fase crónica, forma con patología demostrada
• Recomendaciones referidas al tratamiento tripanocida en las distintas
fases de la infección: indicaciones y grados de recomendación, esquemas
de dosificación, descripción de efectos adversos y su manejo.
• Acciones preventivas sanitarias: control en bancos de sangre, cribado
y tratamiento tripanocida en población infectada, orientación laboral
para los pacientes infectados.
• Niveles de atención que se pretende abarcar: estas pautas están
dirigidas a todos los niveles de atención que asistan pacientes
infectados por T. cruzi, con especial énfasis en el primer nivel de
atención.
Metodología: Las presentes Pautas fueron elaboradas por la Dirección de
Enfermedades Transmisibles por Vectores del Ministerio de Salud de la
Nación (Programa Nacional de Chagas) y el Centro Nacional de Diagnóstico
e Investigación de Endemoepidemias (CeNDIE), Instituto Nacional de
Parasitología “Dr. Mario Fatala Chabén” basada en la revisión
bibliográfica y el consenso informal de expertos. En primera instancia,
expertos de las instituciones de referencia revisaron las guías del
Ministerio de Salud aprobadas en el año 2006 y elaboraron un documento
preliminar que fue puesto a consideración de otros expertos invitados,
Sociedades Científicas y otros Organismos Nacionales (OPS/OMS 1999) (ver
sección Instituciones participantes). Esto se concretó mediante la
realización de dos reuniones presenciales (en Noviembre de 2011 y Marzo
de 2012) e intercambio epistolar (correo electrónico). En base a los
comentarios recibidos en cada punto considerado, los referentes
nacionales elaboraron la versión final de las presentes Pautas, las
cuales fueron presentadas a las Instituciones participantes del proceso
de revisión para que formalicen su adhesión a las mismas. La elaboración
de las presentes pautas no contó con financiamiento externo.
La vigencia de este documento tiene un plazo de 5 años, tras lo cual
deberán ser revisadas por las autoridades nacionales competentes,
pudiendo realizarse una convocatoria anticipada en caso de existir
cambios importantes en la atención de los pacientes infectados por T.
cruzi que lo justifiquen.
2. PARASITO, VECTOR Y FORMAS DE
TRANSMISION
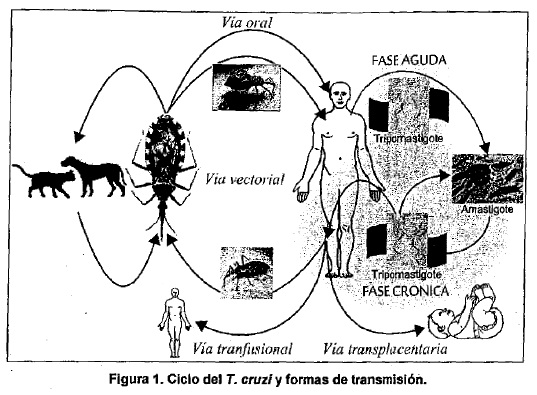
La Enfermedad de Chagas o Tripanosomiasis americana es producida por un
parásito unicelular llamado T. cruzi que se transmite por varias vías.
Dicho parásito se presenta en la sangre de los vertebrados en forma de
tripomastigote, que es extremadamente móvil y se caracteriza por la
presencia de un flagelo. En los tejidos, el parásito se encuentra como
amastigote, pudiendo persistir en esta forma varios años. El insecto
vector, llamado popularmente “vinchuca”, puede compartir la vivienda con
el hombre. La especie más importante en el Cono Sur de las Américas es
Triatoma infestans.
El T. cruzi entra al tubo digestivo del insecto cuando éste pica a una
persona o a un mamífero infectado. El parásito se divide activamente en
el intestino del insecto, dando origen a las formas infectantes las
cuales son transmitidas a través de sus heces, que son depositadas
mientras succiona sangre, a pocos milímetros de la picadura. Esta vía de
transmisión, llamada vectorial, puede ocurrir en el área de dispersión
de triatominos en la región de las Américas, comprendida entre el límite
de México con los Estados Unidos de Norte América y el sur de Chile y
Argentina.
Las vías de transmisión no vectoriales, en las que no participa la
vinchuca, son: a) transmisión de la madre infectada a su hijo durante el
embarazo (transmisión vertical), b) transfusión de sangre infectada y no
controlada, c) trasplante de órganos, d) ingesta de parásitos,
principalmente por consumo de alimentos contaminados con heces del
vector (aún no se han demostrado casos por esta vía en nuestro país) y
e) accidente de laboratorio. También se debe tener presente el potencial
riesgo de la práctica de compartir jeringas entre usuarios de drogas
inyectables.
La Figura 1 resume el ciclo del parásito y las formas de transmisión.
3. FASES DE LA INFECCION POR T. cruzi
La infección por T. cruzi evoluciona en dos fases: aguda y crónica. Cada
una de ellas presenta características clínicas y criterios diagnósticos
y terapéuticos diferentes.
3.1 Fase aguda
3.1.1 Concepto
La fase aguda de la infección por T. cruzi se caracteriza por la
presencia de parásitos en sangre en concentración elevada, la cual puede
ser detectada por métodos parasitológicos directos como los métodos de
concentración (ver más abajo). Como regla general, la fase aguda se
inicia en el momento de adquirir la infección por cualquiera de sus
vías. Otras formas de presentación, como la reactivación de una
infección crónica en un paciente inmunodeficiente, tienen algunas
similitudes con la fase aguda de la primoinfección (reagudización) por
lo que también serán analizadas en este apartado.
La duración y la presentación clínica de la fase aguda pueden ser
variables, dependiendo de la edad del paciente, del estado inmunológico,
la presencia de comorbilidades y la vía de transmisión. En cuanto a la
presentación clínica, la misma puede ser sintomática, oligosintomática o
asintomática, siendo esta última la forma clínica más frecuente. Por tal
motivo, es indispensable mantener una actitud alerta y considerar la
Enfermedad de Chagas en todo individuo con antecedentes epidemiológicos
(permanencia en área rural endémica, haber recibido transfusiones o
nacido de una madre infectada).
En todo individuo con sospecha clínica (síndrome febril prolongado,
astenia, hepatoesplenomegalia, etc.) de infección aguda por T. cruzi se
debería:
• Realizar el diagnóstico de la infección aguda por métodos de
laboratorio
• Evaluar el estado clínico y potenciales complicaciones
• Evaluar la situación epidemiológica y posibles vías de transmisión
La aparición de un caso de infección aguda por T. cruzi,
independientemente de la vía de transmisión, es una enfermedad de
notificación obligatoria, por lo que el médico interviniente debe:
• Confirmar el caso, definir la vía de transmisión, y tomar la conducta
terapéutica indicada.
• Hacer de inmediato la notificación a la Dirección de Epidemiología
Provincial y al Programa Provincial de Chagas (tal como se describe en
la sección Vigilancia epidemiológica).
3.1.2 Evaluación de la vía de transmisión
Ante un supuesto caso agudo deben evaluarse los siguientes datos con el
fin de determinar la vía de transmisión más probable:
• Antecedentes epidemiológicos y ecológicos (conocimiento del vector,
características de la vivienda, lugar de residencia, lugar de
nacimiento/procedencia, viajes a zonas endémicas, etc.).
• Antecedentes de infección de la madre (y evaluación serológica de la
misma), para la transmisión vertical.
• Antecedentes transfusionales dentro de los 90 días previos a la
consulta.
• Antecedentes de trasplante en los últimos 12 meses previos a la
consulta.
• Antecedentes de patologías que generan inmunodepresión.
• Antecedentes de inicio de tratamientos que generen inmunosupresión, o
aumento de la inmunosupresión, previo a la consulta.
• Antecedente de infección crónica del paciente, para definir si se
trata o no de una reactivación.
• Probabilidad de infección accidental, especialmente en personas que se
desempeñen en laboratorios o ámbitos quirúrgicos.
3.1.3 Diagnóstico de la infección aguda por T. cruzi
Para confirmar la infección en la fase aguda sería de elección demostrar
la presencia del parásito por métodos parasitológicos directos. Entre
éstos, los métodos de concentración en una muestra de sangre serían los
indicados debido a la sensibilidad adecuada ante el nivel de parasitemia
existente en esta fase, ya que podrían ser realizados en laboratorios de
baja complejidad. Las “Normas para el diagnóstico de la infección por T.
cruzi” del Ministerio de Salud de la Nación detallan las
especificaciones de estas pruebas diagnósticas (De Rissio 1996,
Ministerio de Salud 2012). Los métodos de concentración que pueden
utilizarse, en orden de menor a mayor complejidad son:
• Gota fresca
• Micrométodo con capilares (Técnica de microhematocrito)
• Micrométodo con microtubo
• Strout
En casos de pacientes con síntomas neurológicos, toda vez que se pueda,
también se debería buscar la presencia de parásitos en líquido
cefalorraquídeo.
La reacción en cadena por la enzima polimerasa (PCR de sus siglas en
inglés) es una técnica que permite la amplificación in vivo de
fragmentos de ADN del parásito que puede realizarse en centros que
cuenten con infraestructura adecuada (mayor complejidad). Sin embargo,
debido a su mayor sensibilidad en comparación con los métodos de
concentración, la PCR puede ser positiva en una infección crónica (Britto
C 1999, 2001).
La seroconversión positiva entre dos análisis con 30 a 90 días de
intervalo podría también servir como diagnóstico confirmatorio de fase
aguda si no puede realizarse la parasitemia. Sin embargo, se debe
recordar que la seroconversión tiene menor valor en el diagnóstico de
fase aguda en pacientes con tratamientos o enfermedades que generen
inmunosupresión o inmunodepresión. Las pruebas serológicas se utilizan
para detectar anticuerpos circulantes (lnmunoglobulinas G - IgG) contra
el parásito. Las IgGs pueden detectarse antes de los 30 días de ocurrida
la infección aguda, alcanzando su nivel máximo al tercer mes. Con el fin
de detectar IgG se pueden emplear los siguientes métodos diagnósticos:
• Ensayo inmuno-enzimático (ELISA) (Voller A 1975, Cura EN 1993).
• Inmunofluorescencia indirecta (IFI) (Alvarez M 1968).
• Hemoaglutinación indirecta (HAI) (Cerisola JA 1971).
• Aglutinación con partículas de gelatina.
Todas estas técnicas son factibles de realizar en centros de baja
complejidad y es necesario que las mismas estén integradas un Programa
de Control de Calidad de Diagnóstico (Cura EN 1994, Remesar MC 2009).
En algunos casos en particular (reactivaciones cerebrales, lesiones
dérmicas), la biopsia sería de gran utilidad para establecer el
diagnóstico.
3.1.4 Evaluación general del paciente y tratamiento
En todo paciente con infección aguda por T. cruzi se debería realizar un
examen clínico para detectar posibles manifestaciones que requieran
tratamiento sintomático, además del tratamiento antiparasitario
específico. Se debería realizar interrogatorio y examen físico
completos. Adicionalmente se recomienda la realización como mínimo de un
electrocardiograma (ECG), (Lazzari JO 1998) una telerradiografía de
tórax y un laboratorio incluyendo hemograma, eritrosedimentación,
creatinina o urea, y hepatograma. Estos últimos estudios permitirán
realizar un monitoreo de seguridad del tratamiento farmacológico. La
realización de otros estudios complementarios será guiada por la
presencia de signos y síntomas. Debería tenerse en cuenta que la
realización de estudios cardiológicos no debería retrasar el inicio del
tratamiento.
El objetivo principal del tratamiento en la fase aguda de la infección
consistiría en la eliminación del parásito mediante el tratamiento
parasitario específico. Debido a que el tratamiento tripanocida comparte
características similares en todas las fases de la infección por T.
cruzi, independientemente de la vía de transmisión, el tratamiento
específico se describe en forma global en la sección Tratamiento
etiológico tripanocida. Recordar además que se deberían suministrar
todas las medidas de soporte y control sintomático necesarias
dependiendo de la presentación clínica y las manifestaciones que
presente el paciente con infección aguda.
En el Anexo I se adjunta a modo de ejemplo un modelo de historia clínica
del paciente infectado por T. cruzi con tratamiento tripanocida, cuyo
uso es opcional. Se recomienda su revisión para identificar elementos
faltantes en el modelo de historia clínica de la institución donde se
atienda el paciente.
3.1.5 Enfermedad aguda vectorial
Si bien la infección adquirida por transmisión vectorial puede
presentarse a cualquier edad, el mayor riesgo se encuentra en los niños
menores de diez años. La fase aguda de la infección adquirida por esta
vía puede durar entre 2 y 4 meses, y cursa en la mayoría de los casos en
forma asintomática.
a) Signos y síntomas
A continuación se detallan los posibles signos y síntomas que pueden
presentarse durante la infección aguda por vía vectorial, pudiendo
clasificarse a los mismos en específicos (propios de la enfermedad, pero
de presentación más infrecuente) y en los inespecíficos (de presentación
más frecuente pero no exclusivos de la infección aguda por este
parásito). Estos signos y síntomas pueden aparecer dentro de las 3
primeras semanas después de ocurrida la transmisión (período de
incubación).
Manifestaciones clínicas inespecíficas: son más frecuentes que los
signos específicos, pudiendo estar presentes además en casos agudos
adquiridos por otras vías de transmisión. En este subgrupo, se incluyen
signos y síntomas generales que en zonas endémicas, por sí solos, deben
hacer sospechar una infección aguda por T. cruzi.
• Fiebre. El diagnóstico diferencial de Enfermedad de Chagas debería ser
considerado en todo paciente con síndrome febril prolongado y
epidemiología compatible.
• Hepatoesplenomegalia
• Adenomegalias
• Anemia
• Edemas
• Irritabilidad o somnolencia
• Convulsiones
• Meningoencefalitis
• Manifestaciones de miocarditis: taquicardia, arritmias, insuficiencia
cardíaca, cardiomegalia.
Las expresiones clínicas más graves de la fase aguda son la miocarditis
y la meningoencefalitis, pudiendo éstas conducir al fallecimiento del
paciente. Las hepatoesplenomegalia, anemia, anorexia y edemas son de
aparición más frecuente en lactantes y niños menores de 4 años.
Manifestaciones clínicas específicas: se presentan en sólo el 5% de los
casos agudos (Lugones H 1978). Se incluye:
• Chagoma de inoculación: puede presentarse en cualquier parte del
cuerpo, pero es más frecuente en cara, brazos y piernas. Es poco o nada
doloroso. Puede tener aspecto forunculoide, erisipelatoide, tumoroide o
lupoide. Generalmente tiene adenopatía satélite.
• Complejo oftalmoganglionar (signo de Romaña): forma particular de
chagoma de inoculación el cual consiste en la presencia de edema
bipalpebral unilateral, elástico e indoloro; eritema rosado tenue, rojo
o rojo violáceo; adenopatía satélite, conjuntivitis y dacrioadenitis. Es
muy importante tener presente que el chagoma puede durar entre 1 y 3
semanas. Menos frecuentemente se observan: exoftalmos, dacriocististis,
queratitis, edema de hemicara.
• Chagoma hematógeno: son tumoraciones planas, que toman dermis y tejido
celular subcutáneo, generalmente no adheridas a planos profundos, únicos
o múltiples. El tamaño puede ser variable. La localización más frecuente
es abdomen inferior, nalgas y muslos. En general son indoloros y pueden
ser sensibles a la presión. Habitualmente no alteran el color de la piel
suprayacente.
• Lipochagoma geniano: es el chagoma que toma la bola adiposa de Bichat.
Puede ser de consistencia lipomatosa o dura. Generalmente es doloroso y
en lactantes puede dificultar el amamantamiento.
El chagoma de inoculación, y en particular el complejo
oftalmoganglionar, es indicativo de la puerta de entrada en la vía de
transmisión vectorial.
b) Seguimiento de la infección aguda vectorial
La infección aguda por vía vectorial constituye una verdadera urgencia
epidemiológica, dado que es un marcador de la presencia del vector y de
transmisión activa en la región, por lo que se requeriría la
implementación de medidas de evaluación y control entomológico en el
área donde se produjo. La infección aguda por vía vectorial es uno de
los eventos que se describe en la sección Acciones preventivas
sanitarias.
El tratamiento antiparasitario específico y el seguimiento del paciente
se describen en la sección Tratamiento etiológico tripanocida.
3.1.6 Chagas congénito
Se estima que la vía congénita de infección sería la vía más frecuente
en la generación de nuevos casos. El Chagas congénito sería la forma
aguda de infección más frecuente en la Argentina. (Gurtler R 2003).
Debido a que la infección por T. cruzi de la madre es un elemento
indispensable en la génesis de un caso congénito, las medidas de control
clínico deberían comenzar antes del nacimiento del bebé, mediante la
evaluación de toda mujer embarazada.
a) Control de la embarazada
De acuerdo a la ley nacional Nro. 26.281/07, toda mujer embarazada
debería ser estudiada para confirmar o descartar una infección crónica
por T. cruzi a través de una muestra de sangre. Idealmente, dicho
estudio debería solicitarse en su primer control prenatal. Para ello
deberían realizarse dos pruebas serológicas en paralelo (ver sección
Diagnóstico de la fase crónica) (Mallimaci MC 2001). En toda mujer
embarazada que llegue al parto sin este estudio, debería realizarse el
mismo durante su internación en el Centro Asistencial. Se recomienda
verificar el resultado antes del alta.
En caso de realizar un diagnóstico de infección en una mujer embarazada,
la misma debería completar los estudios y evaluación descritos en la
sección Fase crónica. Recordar que la infección crónica no constituye
una urgencia y que el embarazo contraindicaría la realización de
estudios radiológicos y no se recomienda el tratamiento tripanocida en
este período (ver sección Tratamiento etiológico tripanocida). El
diagnóstico de infección crónica por T. cruzi en toda mujer en edad
fértil obligaría al estudio y evaluación de toda su descendencia. Los
hijos mayores de 10 meses deberían ser estudiados como se describe en la
sección Diagnóstico de fase crónica. La infección por T. cruzi de la
madre no constituye una contraindicación para la lactancia.
b) Control del recién nacido
De acuerdo a la ley nacional de pesquisa neonatal Nro. 26.279 del año
2007, todos los recién nacidos vivos deberían ser estudiados luego del
nacimiento para descartar una eventual infección congénita por T. cruzi.
Además, la ley Nro. 26.281/07 hace obligatorio el seguimiento y estudio
de todo niño de madre con infección crónica por T. cruzi hasta el año de
vida.
La confirmación diagnóstica de la infección congénita podría realizarse
mediante la identificación directa del parásito en sangre (en las
primeras semanas de vida) (Freilij 1083, De Rissio 2010) o por
demostración de la serología reactiva una vez que desarrolle su sistema
inmunológico (a partir de los 10 meses de edad) (Blanco SB 2000). Debido
a que la parasitemia inicial en la infección congénita puede ser baja y
no detectable por los métodos convencionales de concentración, la
exclusión de la infección congénita sólo podría realizarse luego de un
seguimiento adecuado del recién nacido que permita demostrar que no
desarrolló anticuerpos anti- T. cruzi a partir de los 10 meses de vida
(Sonia SB 2000, De Rissio AM 2010, Mallimaci C 2010).
c) Signos y síntomas
En cuanto a las manifestaciones clínicas, la mayoría de los niños con
infección congénita, aproximadamente 90%, serían asintomáticos. (Freilij
H 1995, Blanco SB 2000) Los casos con manifestaciones clínicas podrían
presentar:
• Hepatomegalia
• Esplenomegalia
• Ictericia
• Prematurez
• Bajo peso
• Anemia
• Taquicardia persistente
Menos frecuentemente podría observarse:
• Hepatitis neonatal
• Sepsis
• Miocarditis
• Meningoencefalitis
• Edemas
• Fiebre
• Exantemas
Con menos frecuencia podría presentarse:
• Megaesófago
• Megavejiga
• Neumonitis
• Calcificaciones cerebrales
Los signos o manifestaciones de la infección congénita podrían ser de
aparición precoz en el período neonatal inmediato, o tardío después de
los 30 días.
d) Diagnóstico y seguimiento de la infección congénita
Todo recién nacido de madre con infección crónica por T. cruzi debería
ser estudiado y seguido para confirmar o descartar una infección
trasplacentaria. El tratamiento tripanocida estaría indicado una vez que
se confirme la infección, tal como se describe en la sección Tratamiento
etiológico tripanocida. Para la evaluación de todo recién nacido se
recomienda el siguiente esquema, el cual se resume en la Figura 2:
Primer control del recién nacido: Implementar la búsqueda directa de T.
cruzi por medio de un Micrométodo parasitológico en el período
perinatal, preferentemente antes del alta del Centro Asistencial o lo
más cercano al nacimiento. Para más detalles sobre la realización de
pruebas de Micrométodo se sugiere consultar las “Normas para el
diagnóstico de la infección por T. cruzi’’, del Ministerio de Salud de
la Nación. En todo niño cuyo control comience después del alta, el
estudio de la infección congénita podría iniciarse con un método
parasitológico directo hasta el noveno mes de vida. Sin embargo, la
sensibilidad de estos métodos disminuye después del tercer mes. Si el
resultado parasitológico es positivo, se debería realizar el tratamiento
etiológico. En caso de ser negativo, el niño debería ser evaluado
nuevamente entre los 10 a 12 meses con métodos de detección de
anticuerpos específicos.
Control del niño a partir de los 10 meses de edad: Llegados a este
momento del seguimiento de un posible caso de infección congénita, la
parasitemia será negativa. Por tal motivo, sería necesario estudiar la
respuesta inmunológica del niño mediante la realización de un análisis
de sangre con dos técnicas serológicas en paralelo, tal como se describe
en la sección Diagnóstico de la fase crónica. No se recomienda la
realización de estudios serológicos antes de los 8 meses de vida dado
que un resultado reactivo antes de esta edad podría ser el resultado de
una transferencia de anticuerpos maternos, y no por infección congénita.
Una vez que se descarte la infección congénita por métodos serológicos
(a partir de los 10 meses) el niño podría ser dado de alta del
seguimiento. En el caso que los estudios confirmen la ocurrencia de la
infección congénita, el niño debería ser tratado.
A todo niño que reciba tratamiento tripanocida en área endémica,
independientemente de que la infección haya sido adquirida por vía
congénita, el Programa Provincial de Control de Vectores debería
intervenir para que la vivienda y el peridomicilio estén libres de
triatominos.

3.1.7 Pacientes inmunocomprometidos
Existen dos posibilidades que podrían suceder en un paciente
inmunocomprometido: i) que una infección crónica se reactive, (Freilij
1995, Ferreira MS 1997, Nishioka 2000) o ii) que adquiera una infección
aguda por diferentes vías de transmisión. En ambas circunstancias, el
cuadro clínico es muy grave y requeriría un rápido diagnóstico a fin de
que el tratamiento etiológico sea efectivo, para evitar complicaciones
asociadas.
En las formas agudas o reagudizadas en pacientes inmunodeficientes, las
manifestaciones más frecuentes serían el síndrome febril prolongado y
las neurológicas (meningoencefalitis y/o granuloma cerebral). En orden
de frecuencia le seguirían las manifestaciones cardiológicas
(miocarditis, arritmias, insuficiencia cardíaca). También podría
observarse en pacientes trasplantados cardíacos lesiones como la
paniculitis aguda en brazos, piernas y abdomen (Sartori AMC 1999).
a) Personas con infección por virus de inmunodeficiencia humana (VIH)
Se estima que el riesgo de reactivación en una persona con infección
crónica por T. cruzi se iniciaría cuando tiene recuentos de CD4
inferiores a 200 células/mm3, al igual que para otras enfermedades
oportunistas. Las manifestaciones más frecuentes de la reactivación en
estos pacientes serían miocarditis, meningoencefalitis, pseudotumores
cerebrales, miocarditis y síndrome febril prolongado. La mortalidad es
muy elevada si no se realiza un diagnóstico precoz que permita instaurar
rápidamente el tratamiento etiológico.
Desde el punto de vista clínico, toda persona con infección por VIH
debería ser estudiada con el fin de descartar una infección crónica por
T. cruzi (ver sección Diagnóstico de fase crónica), y de confirmarse
ésta se debería iniciar los cuidados descritos en la sección
correspondiente. Todo paciente con infección crónica por T. cruzi en el
cual se haga diagnóstico de infección por VIH debería iniciar
tratamiento antirretroviral de gran actividad (TARGA) de acuerdo a los
criterios de guías nacionales o internacionales.
El tratamiento indicado para las reactivaciones por Enfermedad de Chagas
en pacientes inmunodeprimidos por infección por VIH es el convencional,
descrito en la sección Tratamiento etiológico tripanocida. Sin embargo,
la duración del tratamiento no ha sido definida, pudiendo ser necesario
prolongar el tratamiento más allá de los 60 días en casos no haya
cambios favorables en la clínica o en las imágenes. Simultáneamente, el
paciente debería recibir el TARGA con el objetivo de recuperar un valor
de CD4 superior a 200 células/mm3. Una vez concluido el tratamiento de
la fase aguda, y de persistir el paciente con un recuento de CD4
inferior a 200 células/mm3 podría indicarse profilaxis secundaria. Para
la profilaxis secundaria se emplean las mismas drogas y dosis diarias
que las descritas en la sección Dosis tripanocidas pero en forma
trisemanal. La indicación de profilaxis secundaria es empírica (derivada
del manejo de otras infecciones oportunistas) dado que no hay estudios
al respecto.
b) Trasplante de órganos y de células hematopoyéticas
Todo donante y receptor de órganos debería tener el estudio serológico
para esta parasitosis. Dicha evaluación debería realizarse con dos
reacciones simultáneas tal como se describe en la sección Diagnóstico de
fase crónica. Cualquiera sea la indicación de intervención terapéutica
por la patología de base sobre el paciente, debería seguirse un
protocolo estandarizado recomendado por expertos para el diagnóstico,
tratamiento y seguimiento de la potencial reactivación en un paciente
con infección crónica que será inmunodeprimido, así como de la infección
aguda transmitida por el órgano donado o trasplantado (Anónimo 1996,
Riarte A 1999, Zayas CF 2001, Sociedad Argentina de Infectología 2007,
2011). Al respecto se considera:
Reactivación: cuando el receptor es reactivo, es decir, con infección
crónica previa al trasplante, en el que se detecte presencia de
parásitos en sangre por métodos directos o se detecten parásitos en una
lesión por biopsia. Esta definición es independiente de la situación del
donante (donante reactivo o no). Las principales manifestaciones
clínicas de la reactivación son signos neurológicos (meningitis,
encefalitis, accidente cerebrovascular, granuloma), cardíacos
(miocarditis, insuficiencia cardíaca, arritmias), dermatológicos (paniculitis).Otros
síntomas inespecíficos incluyen fiebre, fatiga, anorexia y diarrea. En
estos pacientes, una prueba de PCR positiva puede ser orientadora de una
reactivación.
Transmisión por el órgano/células hematopoyéticas: cuando el receptor es
no reactivo, con donante reactivo, en el que: a) se detecte presencia de
parasitemia por métodos directos de concentración o PCR cuantitativa, b)
se detecten parásitos en una lesión por biopsia, y/o c) se demuestre
seroconversión positiva. En el caso del trasplante de células
hematopoyéticas se considera un período mínimo de 30 días y hasta 60
días postrasplante para definir una primoinfección.
Protocolo de seguimiento: Desde el punto de vista clínico, todo paciente
trasplantado con riesgo de reactivación o de infección aguda debería ser
controlado periódicamente por métodos parasitológicos directos por
concentración, tal como se describe en la sección Diagnóstico de la
infección aguda por T. cruzi. Se recomienda realizar controles semanales
durante los 3 primeros meses, mensualmente hasta el año y bianual
posteriormente. Se sugiere además, siempre que fuera posible y se
encuentre disponible, sumar la PCR a los métodos directos. En el caso de
pacientes con PCR positiva antes del trasplante se sugiere utilizar para
el monitoreo de una eventual reactivación la PCR cuantitativa para
evaluar el incremento de la carga parasitaria post-trasplante. En estos
pacientes, se recomienda volver al esquema de seguimiento inicial (con
controles semanales) en toda situación clínica de etiología no aclarada
que sea compatible con reactivación de una infección crónica (por
ejemplo síndrome febril prolongado).
En casos de receptor no reactivo y donante vivo reactivo, se recomienda,
de ser posible, realizar tratamiento al donante durante al menos 30 días
(idealmente 60 días) previos al trasplante, a fin de disminuir la carga
parasitaria y el riesgo de transmisión al receptor. La imposibilidad de
realizar este tratamiento en el donante no contraindica el trasplante.
El tratamiento de la reactivación o de la infección aguda se describe en
la sección Drogas parasiticidas. Además, durante el tratamiento se
recomienda realizar un seguimiento parasitológico por métodos de
concentración para demostrar la efectividad del tratamiento.
c) Otras condiciones de inmunodeficiencia
Se debería realizar serología para T. cruzi con el objetivo de detectar
una infección crónica previo al inicio de todo tratamiento
quimioterápico en oncología, o tratamiento inmunosupresor en
reumatología. En los pacientes con grave compromiso de su inmunidad y
con infección crónica por T. cruzi, se recomienda realizar monitoreo
clínico, serológico y parasitológico por técnica de concentración en
sangre en forma periódica. La conducta indicada ante el diagnóstico de
una reactivación de la infección por T. cruzi es realizar el tratamiento
específico considerando al caso como una forma aguda de la enfermedad
(ver sección Tratamiento etiológico tripanocida).
3.1.8 Enfermedad de Chagas postransfusional
El control y prevención de la infección por T. cruzi por vía
transfusional comienza con el control de los donantes de sangre y la
implementación de programas de sangre segura (ver sección Acciones
preventivas sanitarias). El control del donante consiste en la
realización de dos reacciones serológicas simultáneas y se recomiendan
las de mayor sensibilidad, la mejor combinación puede ser ELISA
recombinante+ ELISA de lisado de parásito. En la mayoría de los bancos
de sangre se utilizan pruebas de rastrillaje con valores de corte más
bajos, y por lo tanto más sensibles, que los utilizados para la
confirmación de la infección crónica. Por tal motivo, todo donante
reactivo en banco de sangre debería ser derivado a un efector de salud
para confirmar el diagnóstico y recibir la atención médica pertinente.
Según reporte técnico de OMS (2009 Recommendations Screening Donated
Blood for Transfusion-Transmissible Infections) y Normas Técnicas de
Hemoterapia (Resolución Ministerial 865/06) el uso de dos técnicas de
Elisa (de antígeno de lisado u homogenato total y de antígenos
recombinantes) es recomendable.
a) Signos y síntomas
Desde el punto de vista clínico, se debería tener presente esta vía de
transmisión en todo paciente con síntomas compatibles de infección aguda
(fiebre, hepatoesplenomegalia, astenia, etc.) que comiencen luego de una
transfusión de sangre (en los 30 a 90 días previos al inicio de los
síntomas). Cuando se estima que un paciente es candidato a ser
transfundido con muchas unidades o bien crónicamente, es conveniente
realizar un estudio serológico antes de comenzar con las mismas.
El período de incubación de la infección por vía transfusional varía
entre 1 y 3 meses. La enfermedad se manifiesta con fiebre moderada: 37,5
a 38,5°C. Se observa también la presencia de linfadenopatías y
esplenomegalia moderada en el 80% de los pacientes. Pueden observarse en
la piel áreas eritematosas, no pruriginosas de tamaño considerable. Aún
sin tratamiento los síntomas pueden desaparecer y todavía persistir la
infección (Bergoglio R 1984).
Ante la sospecha de todo caso de infección aguda postransfusional de T.
cruzi se debería contactar al banco de sangre correspondiente a fin de
evaluar al donante.
b) Diagnóstico y seguimiento de la infección por vía transfusional
Ante la sospecha de Enfermedad de Chagas postransfusional deberían
realizarse estudios parasitológicos cada 72 h las primeras 2 semanas y
luego quincenalmente, y serológicos seriados cada 15 días hasta los 90
días posteriores a la ultima transfusión de sangre y/o sus componentes.
En laboratorios que cuenten con un método estandarizado, podrían usarse
métodos moleculares para detección del parásito (PCR). Si se comprueba
la infección (por detección del parásito o seroconversión positiva), se
debe proceder a administrar el tratamiento específico (ver sección
Tratamiento etiológico tripanocida).
3.1.9 Accidentes de trabajo con material contaminado con T. cruzi
Los trabajadores que realizan su actividad con materiales que contienen
o puedan contener T. cruzi deberían controlarse serológicamente antes de
iniciar la actividad laboral. Estas actividades son, entre otras:
diagnóstico de laboratorio, investigaciones biomédicas, cirugía y
hemodiálisis. Se deberá realizar seguimiento y control de los
trabajadores en forma anual o bianual y frente a toda ocurrencia de
síntomas compatibles con infección por T. cruzi.
Los accidentes en el trabajo que impliquen riesgo pueden presentar
diferentes características. La conducta a seguir debería evaluarse en
cada caso en particular. Sólo a fin de esquematizar dividimos la
ocurrencia de los mismos en dos grandes grupos:
• Accidentes con comprobación de contacto de fluido con parásitos con la
piel sin solución de continuidad (sin herida) o ingesta.
• Accidentes con comprobación o sospecha de contacto de fluido con
parásitos con mucosas, conjuntivas o piel con solución de continuidad.
a) Atención y evaluación inicial
Existen conductas generales que comprenden, siempre que no sean mucosas,
conjuntivas o heridas anfractuosas, la aplicación local inmediata de
alcohol al 70%. En caso de mucosas y conjuntivas se debería lavar con
solución fisiológica, y en casos de heridas anfractuosas, con alcohol
yodado. Además, se deberían realizar un examen físico completo y
estudios bioquímicos incluyendo hemograma, eritrosedimentación,
creatinina o urea, hepatograma, estudio parasitológico directo y
serológico (este último permite descartar una infección previa, pudiendo
además servir como base para demostrar una seroconversión positiva).
Cuando se compruebe o sospeche inoculación a través de piel o contacto
de T. cruzi con mucosas o conjuntivas debería implementarse el
tratamiento específico antiparasitario durante por lo menos 15 días a
las dosis estándares, como se describe en la sección Tratamiento
etiológico tripanocida.
b) Seguimiento
Deberían realizarse estudios parasitológicos y serológicos según el
siguiente esquema:
• inmediatamente de ocurrido el accidente (sólo serología)
• a los 15 días de iniciado el tratamiento (de ser instituido)
• al finalizar el tratamiento tripanocida (de ser instituido)
• en forma semanal durante el 1° mes de seguimiento
• en forma quincenal durante el 2° mes de seguimiento
• en forma mensual hasta el 4° mes del accidente
• ante la aparición de signos y/o síntomas compatibles con infección
aguda
Se consideraría el alta del seguimiento si al cabo de 4 meses no ocurrió
seroconversión o aparición de parasitemia por métodos directos de
concentración o moleculares (PCR).
3.2 Fase crónica
3.2.1 Concepto
Corresponde a la etapa que sigue a la fase aguda y comienza cuando la
parasitemia se vuelve indetectable por los métodos parasitológicos
directos por concentración. En esta fase, la infección es detectable
principalmente por métodos serológicos (que demuestran la respuesta
inmunológica del huésped frente al parásito) y también por métodos
moleculares.
Debido a que la mayoría de las infecciones agudas por T. cruzi ocurren
en forma asintomática, una gran proporción de las personas infectadas
son diagnosticadas en la fase crónica, por lo tanto esta fase debería
sospecharse en cualquier individuo que:
• Resida o haya residido en zonas endémicas en forma habitual o
esporádica, tenga o no antecedentes clínicos compatibles con enfermedad
de Chagas aguda o contacto con el vector.
• Su madre biológica esté infectada por T. cruzi.
• Haya recibido transfusión de sangre y/o hemoderivados.
• Haya sido o sea usuario de drogas inyectables.
• Refiera tener o haber tenido síntomas o signos compatible con
infección por T cruzi.
• Tuviera familiar cercano que presentara enfermedad cardíaca o muerte
súbita a edades tempranas y/o con antecedentes de serología reactiva
para T. cruzi.
La mayor parte de las personas con infección crónica cursan el resto de
su vida en forma asintomática. Aproximadamente el 30% de estas personas
desarrollarían lesión de órganos (principalmente a nivel cardíaco y/o
digestivo), en un plazo de 10 a 20 años, con signos y síntomas de
expresión variada. De acuerdo a ello, esta fase se clasifica en dos
formas clínicas: con patología demostrada y sin patología demostrada
(anteriormente llamada forma indeterminada) (Rosembaum M y Cerisola JA
1961).
3.2.2 Diagnóstico de fase crónica
El diagnóstico de la fase crónica de la infección por T. cruzi se
confirma al demostrar la respuesta inmunológica del huésped frente al
parásito. Para ello deberían realizarse al menos dos reacciones
serológicas normatizadas de principios distintos que detecten
anticuerpos diferentes. Ambas pruebas deberían realizarse con la misma
muestra de suero, siendo necesario además utilizar por lo menos una de
las pruebas de mayor sensibilidad como ELISA o IFI. Para considerar el
diagnóstico como definitivo (ya sea confirmando o descartando una
infección crónica), el resultado de ambas pruebas debería ser
coincidente (ambas reactivas o ambas no reactivas). En caso de
discordancia (una prueba reactiva y otra no reactiva) se debería
realizar una tercera prueba, o derivarla a un centro de referencia.
Se debe tener presente que el valor diagnóstico de las pruebas
serológicas debería interpretarse con cuidado en las siguientes
situaciones:
• Inmunodepresión o inmunosupresión que anula o compromete la respuesta
inmunológica del huésped, lo cual podría conducir a un resultado
falsamente no reactivo.
• Luego de completado el tratamiento tripanocida. En este caso, la
respuesta inmunológica podría persistir por años luego de eliminado el
parásito, por lo que un resultado serológico reactivo no significaría
fracaso terapéutico ni persistencia de la infección crónica.
3.2.3 Evaluación inicial de la persona con infección crónica
El objetivo principal de la evaluación inicial es determinar si el
paciente presenta o no lesión orgánica compatible con Enfermedad de
Chagas crónica, debido a que el manejo clínico es distinto en cada caso.
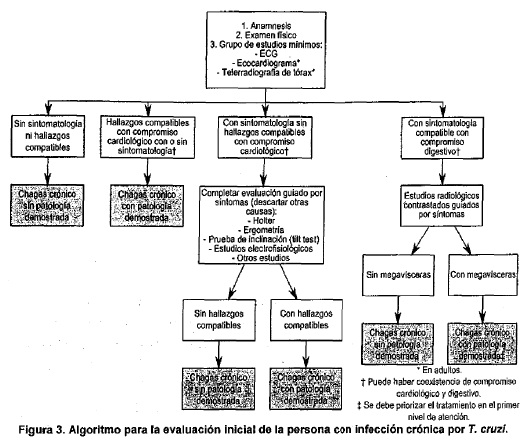
En esta evaluación se recomienda seguir el algoritmo detallado en la
Figura 3. En esta figura se resumen el algoritmo de los 2 sistemas más
afectados con implicancia clínica (cardiovascular y digestivo), aunque
con mucha menor frecuencia también se pueden afectar otros sistemas como
por ejemplo el urinario produciendo mega uréteres. De acuerdo a dicho
algoritmo, la evaluación inicial debería incluir: anamnesis, examen
físico completo y al menos un grupo mínimo de estudios, que podría
ampliarse ante hallazgos patológicos en cualquiera de estas tres
esferas. La definición de las pruebas complementarias que deberían ser
incluidas como parte de este grupo mínimo de estudios resulta un punto
prioritario desde la perspectiva de la Salud Pública dado que permite:
• definir los estándares de calidad con los cuales deben ser estudiados
todos los pacientes.
• evitar que los pacientes sean sobre-invadidos en búsqueda de hallazgos
patológicos de poca o ninguna significancia clínica, evitando molestias,
pérdida de tiempo y costos asociados.
La inclusión de pruebas complementarias como parte del grupo de estudios
mínimo debe basarse en los principios de la Atención Primaria de la
Salud, es decir que sean científicamente validados para su propósito. En
la Argentina, se recomienda realizar un ECG a todos los pacientes con
infección por T. cruzi, independientemente de la ausencia o presencia de
signos compatibles con lesión cardiológica, o de la edad del paciente.
En adultos, se recomienda además realizar una telerradiografía de tórax
y un ecocardiograma.
En el Anexo I se adjunta un modelo de historia clínica del paciente
infectado por T. cruzi con tratamiento tripanocida, cuyo uso es
opcional. Se recomienda su revisión para identificar elementos faltantes
en el modelo de historia clínica de la institución donde se atienda el
paciente.
a) Interrogatorio y examen físico
En los pacientes que cursan la etapa crónica de la enfermedad, el examen
clínico puede proporcionar elementos de juicio que permiten sospechar la
presencia de daño visceral y también establecer aproximadamente la
magnitud del mismo. Al respecto, debería evaluarse con especial atención
la presencia de los siguientes síntomas de lesión visceral:
• Cardiológicos: disnea, mareos, síncope, palpitaciones, edemas, dolor
precordial, fenómenos tromboembólicos.
• Digestivos: dolor epigástrico, disfagia, regurgitación, ardor
retroesternal, constipación persistente y prolongada, antecedentes de
fecaloma.
En cuanto al examen físico deberían evaluarse, entre otros, la presencia
de:
• Signos de insuficiencia cardíaca izquierda o derecha.
• Arritmias, hipotensión arterial y/o bradicardia persistentes.
• Desdoblamiento permanente del segundo ruido como indicador de bloqueo
de rama derecha.
b) Grupo mínimo de estudios
Luego del interrogatorio y el examen físico, de no surgir datos
patológicos que sugieran la presencia de lesión orgánica, se deberían
realizar el siguiente grupo mínimo de exámenes complementarios:
• Electrocardiograma: convencional de doce derivaciones incluyendo una
derivación de duración prolongada, en todos los pacientes.
• Telerradiografía de tórax: proyección de frente, realizada con buena
técnica para permitir una correcta medición de la silueta cardíaca, en
adolescentes y adultos.
• Ecocardiograma bidimensional: en adolescentes y adultos.
c) Otros estudios complementarios
La presencia de signos y síntomas surgidos del interrogatorio o del
examen físico, o el hallazgo de anomalías en el grupo de estudios
mínimos mencionados previamente, puede condicionar la realización de
otros estudios complementarios. Ante la sospecha de disfunción digestiva
se deberían solicitar estudios radiológicos contrastados, dependiendo de
la sintomatología (seriada esofágica o colon por enema). Ante la
presencia de signos, síntomas o resultados patológicos compatibles con
lesión cardíaca se podrían solicitar según los hallazgos: estudio de
Holter, ergometría, Tilt Test, estudio electrofisiológico, estudio de
perfusión miocárdica en reposo y esfuerzo.
A los fines de confirmar la forma clínica sin patología demostrada en
niños asintomáticos y con examen físico normal sería suficiente la
realización de un electrocardiograma. En pacientes adolescentes y
adultos asintomáticos y con examen físico normal serían suficientes el
electrocardiograma, el estudio radiológico de tórax y el ecocardiograma
transtorácico. Esta evaluación es factible de ser realizada en el primer
nivel de atención con efectores de medicina general.
El diagnóstico de patología digestiva y/o cardíaca debe realizarse en
instituciones de segundo y tercer nivel de atención bajo la indicación y
evaluación de especialistas.”
3.2.4 Fase crónica, forma sin patología demostrada
a) Concepto
Esta forma clínica de la infección en fase crónica se caracteriza por la
presencia de serología reactiva para T. cruzi y ausencia de lesión
orgánica compatible (cardíaca o digestiva) que sea clínicamente evidente
o detectable por estudios complementarios. Dicha forma puede durar toda
la vida o, en aproximadamente un 30% de ellas, evolucionan al cabo de 10
a 20 años en una forma clínica con lesión manifiesta (fase crónica con
patología demostrada).
b) Control y seguimiento
Las personas con infección en fase crónica con la forma sin patología
demostrada deberían ser instruidas en forma adecuada sobre su condición
de salud, los riesgos que representa y la importancia del seguimiento y
control periódico a largo plazo. Se debería explicar adecuadamente la
diferencia entre presencia y ausencia de lesión orgánica, así como
señalar que no deben donar sangre. Además, se debería instruir a las
mujeres en edad fértil que en caso de embarazo deben informar a su
obstetra de su condición de infectadas, y todo hijo de mujeres
infectadas debería ser estudiado serológicamente.
Desde el punto de vista del control médico, estas personas deberían ser
controladas una vez por año para detectar cualquier manifestación
orgánica en forma precoz. Se debería aclarar al paciente que estos
controles no son de urgencia. En dichos controles se debería realizar
una evaluación clínica completa y repetir el grupo de estudios mínimos
referidos en la sección Evaluación inicial de la persona con infección
crónica. Eventualmente podrían incluirse estudios adicionales en el caso
de surgir hallazgos patológicos que lo requieran, según el algoritmo
detallado en la Figura 3.
Los pacientes con esta forma de la enfermedad serían candidatos a
recibir tratamiento tripanocida, el cual se describe en la sección
Tratamiento etiológico tripanocida. Hasta que se cuente con nueva
información científica, los pacientes que reciban este tratamiento
deberían continuar con el mismo esquema de seguimiento periódico
descrito previamente.
3.2.5 Fase crónica, forma con patología demostrada
a) Concepto
Se define que un paciente es portador de esta forma clínica de la fase
crónica de la enfermedad de Chagas cuando presenta alguna manifestación
orgánica compatible, ya sea cardíaca, digestiva o hallazgos patológicos
en estudios complementarios. A esta condición llegaría aproximadamente
el 30% de las personas que se infectan, y deriva de la forma sin
patología demostrada descrita precedentemente. Los síntomas y/o signos
son de expresión variada, siendo la forma cardíaca la más frecuente.
b) Control y seguimiento
Es importante la detección precoz de la forma orgánica de la fase
crónica a fin de obtener una mejor respuesta al tratamiento que se
administre. Los trastornos cardiológicos y/o digestivos son variados y
existen numerosos medicamentos, procedimientos médicos y estrategias de
seguimiento para enfrentar situaciones tales como insuficiencia
cardíaca, arritmias (Gonzáles Zuelgarray 2001) o megavísceras, (Lausil I
1964, Rezende JM 1997) los cuales no son pasibles de generalización, y
en algunos casos corresponden al manejo del especialista. Sin embargo,
la evaluación inicial y el control y seguimiento de las formas
incipientes podría realizarse por los efectores del primer nivel de
atención. A continuación se describe la estratificación de riesgo de la
lesión cardiológica de la Enfermedad de Chagas crónica en base al
puntaje de Rassi (Rassi Jr 2007). El mismo consiste en la evaluación de
seis factores:
|
Factores |
Puntaje |
|
1. Género
masculino |
2 |
|
2. QRS bajo
voltaje (QRS < 0,5 mV; I, II, III, aVL, aVF, aVR) |
2 |
|
3. Taquicardia
ventricular no sostenida (por monitoreo Holter 24 h.) |
3 |
|
4. Alteración
segmentaria o global de la motilidad VI (Eco 2D) |
3 |
|
5. Cardiomegalia
(telerradiografía de Tórax con índice cardiotorácico > 0,5) |
5 |
|
6. Clase
Funcional NYHA III o IV |
5 |
La taquicardia ventricular no sostenida queda definida por la presencia
de tres o más latidos consecutivos originados en tejido ventricular con
una frecuencia promedio de 100 latidos por minuto durante no más de 30
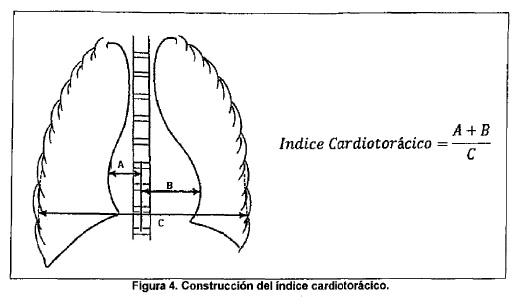
segundos. En cuanto al índice cardiotorácico, el mismo se construye como
se muestra en la Figura 4.
En base al puntaje total obtenido pueden definirse los siguientes
niveles de riesgo:
|
Puntaje total |
Mortalidad total |
Riesgo |
|
5 años |
10 años |
|
0-6 |
2% |
10% |
Bajo |
|
7-11 |
18% |
40% |
Mediano |
|
12-20 |
63% |
84% |
Alto |
También, es posible utilizar la estadificación de Kuschnir como forma de
evaluar el grado de afectación cardiovascular. De acuerdo a ésta, los
pacientes pueden ser clasificados en los siguientes estadíos:
• Estadío 0: serología reactiva, con ECG y telerradiografía de Tórax
normales.
• Estadío I: serología reactiva, con ECG anormal y telerradiografía de
Tórax normal
• Estadío II: serología reactiva, ECG y telerradiografía de Tórax
anormales.
• Estadío III: serología reactiva, ECG y telerradiografía de Tórax
anormales, más signos y/o síntomas de insuficiencia cardíaca.
En el Anexo II se adjuntan las secciones de manejo de arritmias y
miocardiopatía dilatada chagásica correspondientes al Consenso de
Enfermedad de Chagas-Mazza del año 2011 de la Sociedad Argentina de
Cardiología (Mitelman JE 2011).
El tratamiento tripanocida en esta forma clínica se encuentra en
investigación. Sin embargo, se ha probado que este tratamiento en las
etapas iniciales de la cardiopatía podría demorar la progresión clínica
de la misma, por lo que puede ser considerado como una alternativa
terapéutica en estos pacientes (Andrade SG 1991).
4. TRATAMIENTO ETIOLOGICO TRIPANOCIDA
El tratamiento etiológico tendría objetivos a nivel individual y
colectivo.
A nivel individual:
• Prevenir lesiones viscerales o disminuir la probabilidad de progresión
de la lesión establecida.
• Curar la infección.
A nivel colectivo:
• Disminuir la posibilidad de transmisión del Trypanosoma cruzi por
todas sus vías.
El tratamiento tripanocida en la fase aguda (vertical, vectorial,
transfusional, postrasplante) reduciría la gravedad de los síntomas y
acortaría el curso clínico y la duración de la parasitemia detectable.
La cura parasitológica (demostrable por negativización de la parasitemia
y de la serología) sería superior al 80% en fase aguda vectorial (Barclay
CA 1978) y más del 90% en los casos congénitos tratados durante el
primer año de vida (Schijman AG 2003, Altcheh J 2003). En el caso de
reactivaciones en pacientes con infección por VIH, que conlleva una alta
mortalidad, el tratamiento tripanocida administrado en forma temprana
mejoraría el pronóstico. En pacientes trasplantados con reactivación, la
terapia tripanocida anticipada (tratamiento con parasitemia positiva sin
síntomas de reactivación) y el tratamiento precoz de la reactivación con
síntomas reduciría la morbilidad y mortalidad asociadas.
En niños y adolescentes con infección crónica el tratamiento tripanocida
es en general bien tolerado y ha demostrado una alta tasa de curación de
la infección, demostrable por la seroconversión negativa (de Andrade AL
1996, Blanco S 1997, Sosa-Estani S 1998, 1999, Almeida IC 1999, Streiger
ML 2004). Todas las guías y recomendaciones actuales coinciden en
indicar que los niños y adolescentes con Chagas crónico deberían ser
tratados lo más precozmente posible dado que presentan menos efectos
adversos (Moya PR 1985, del Barco 1993, Solari A 2001, Altcheh J 2011) y
mejor respuesta terapéutica. Un beneficio adicional del tratamiento en
esta población sería la reducción subsecuente del riesgo de Chagas
congénito en la descendencia de las niñas tratadas (Sosa-Estani S 2009,
2012) y el aumento del número de potenciales donantes de sangre y
órganos.
En adultos con infección crónica el tratamiento etiológico también
parecería asociarse a seroconversión negativa sugiriendo la curación de
la infección, aunque la tasa observada sería menor que en niños y
adolescentes, y el tiempo requerido hasta la seroconversión sería mucho
mayor (Kretlli AU 1984, Galvao LMC 1993, Gazzinelli RT 1993, lanni BM
1993, Coura JR 1997, Viotti 1994, Fragatta Filho AA 1995, Krautz GM
1995, Houghton RL 2000, Laura-Pires L 2000, Fabbro DL 2000, 2007,
Gallerano R 2001). Adicionalmente, el tratamiento tripanocida en adultos
menores de 50 años con infección crónica y con lesión cardiológica
incipiente reduciría la progresión a estadios clínicos más avanzados (Viotti
R 1994, 2006, Fabbro DA 2007, Laucella SA 2004, 2009). Sin embargo, el
tratamiento etiológico en este grupo de pacientes es en general menos
tolerado que en niños y adolescentes. El uso de tratamiento tripanocida
en pacientes con lesión orgánica moderada o grave es todavía motivo de
investigación (Villar JC 2002, Doval H 2004, Marin-Neto JA 2008, Reyes
PA 2005, Perez-Molina JA 2009).
4.1.1 Indicaciones del tratamiento tripanocida
Previo al inicio del tratamiento es muy importante que el médico le
explique al paciente los posibles efectos adversos y las medidas
terapéuticas para contrarrestar los mismos. El tratamiento a cualquier
edad debería ser adecuadamente supervisado. (Cançado R 1997, Sosa-Estani
2004, Viotti R 2009, Jackson Y 2010, Hasslocher-Moreno AM 2011, Pinazo
MJ 2013). A continuación se resumen las recomendaciones generales sobre
el uso del tratamiento tripanocida para distintos grupos de pacientes,
las cuales fueron alcanzadas por consenso del grupo de revisión de las
presentes pautas. Dichas recomendaciones se agrupan en 4 categorías,
siguiendo la clasificación propuesta por el grupo GRADE (Sackett 1995,
1997, GRADE 2013).
Hacer: se agrupan en esta categoría aquellas indicaciones para el uso de
drogas tripanocidas en las que se considera que la gran mayoría de las
personas con información adecuada acuerda en realizar. Se incluyen en
esta categoría:
• Fase aguda de cualquier naturaleza (se incluye la reactivación en
inmunocomprometidos).
• Fase crónica en niños y adolescentes menores a 19 años.
• Donante vivo reactivo en trasplante de órganos cuando el mismo no es
de urgencia.
• Accidente de laboratorio o quirúrgico con material contaminado con T.
cruzi.
Probablemente hacer: se incluyen en esta categoría aquellas indicaciones
para el uso de drogas tripanocidas en las que se considera que la
mayoría de las personas con información adecuada acuerda en realizar,
pero en las que una minoría substancial podría no acordar. Se incluyen
en esta categoría:
• Fase crónica, forma sin patología demostrada en pacientes = 19 años y
menores de 50 años.
• Fase crónica, forma con patología demostrada, con hallazgos de
cardiopatía incipiente, en pacientes =19 años y menores de 50 años.
• Quimioprofilaxis secundaria luego de una reactivación en paciente
inmunocomprometido.
Probablemente no hacer: se incluyen en esta categoría indicaciones para
el uso de drogas tripanocidas en las que se considera que la mayoría de
las personas con información adecuada acuerda en no realizar, pero en
las que una minoría substancial consideraría hacerlo. Se incluyen en
esta categoría:
• Fase crónica en pacientes = 50 años.
• Fase crónica con cardiopatía avanzada.
No hacer: se incluyen en esta categoría indicaciones para el uso de
drogas tripanocidas en las que se considera que la gran mayoría de las
personas con información adecuada acuerda en no realizar. Se incluyen en
esta categoría:
• Pacientes embarazadas.
• Insuficiencia renal o hepática graves.
• Trastornos neurológicos graves de base.
4.1.2 Drogas tripanocidas
Actualmente sólo existen dos drogas autorizadas para el tratamiento
etiológico: Benznidazol y Nifurtimox.
Benznidazol: Se presenta en comprimidos birranurados de 50 y 100 mg. En
otros países de la región existen presentaciones dispensables de 12,5
mg, las cuales pueden estar disponibles en el futuro para su uso en la
Argentina.
Dosis: Todas las edades: 5-7 mg/kg/día, administrados en dos tomas
diarias (cada 12 horas) luego de las comidas. Se sugiere una dosis
máxima de 400 mg/día.
Nifurtimox: Se presenta en comprimidos birranurados de 120 mg.
Dosis:
• Recién nacido y hasta los dos meses de vida: 10-12 mg/kg/día,
administrados en dos tomas (cada 12 horas).
• Lactantes, primera y segunda infancia: 10-12 mg/kg/día, administrados
en tres tomas (cada 8 horas).
• Adolescentes y adultos: 8-10 mg/kg/día (máximo 700 mg en 24 horas),
administrados en tres tomas (cada 8 horas).
Las tomas deberían administrarse luego de las comidas.
En prematuros o niños de bajo peso se recomienda iniciar el tratamiento
con dosis bajas de la droga seleccionada, la que puede administrarse en
una sola toma diaria. Luego se puede aumentar la dosis cada 48 a 72
horas, realizando control de hemograma hasta alcanzar la dosis
terapéutica.
Tanto con Benznidazol como con Nifurtimox, la duración del tratamiento
recomendada es de 60 días. Ante el caso de intolerancia al medicamento
que impida completar los dos meses, se podría considerar aceptable si
cumplió al menos 30 días. En caso de suspender el tratamiento por la
presencia de eventos adversos antes de los 30 días, y luego de
controlados los mismos, se recomienda comenzar un nuevo tratamiento con
la droga no utilizada.
4.1.3 Administración y supervisión del tratamiento
El tratamiento del paciente infectado podría y debería realizarse
preferentemente en el Primer Nivel de Atención, lo que permitiría
mejorar la accesibilidad del paciente al tratamiento. El mismo debería
ser supervisado en forma semanal por personal médico capacitado, de
acuerdo a las recomendaciones del presente documento. En caso de que el
personal médico no cuente con experiencia previa en el manejo de estas
drogas, se recomienda buscar asesoramiento adecuado con las autoridades
responsables provinciales o nacionales. Se recomienda además que el
paciente o su cuidador (en el caso de un niño) lleve un registro escrito
de la administración de los comprimidos para su mejor control (ver Anexo
I, Hoja de control de administración de medicamento tripanocida).
Se recomienda realizar durante el tratamiento una dieta baja en grasas e
hipoalergénica. Se debe mantener una abstención absoluta de bebidas
alcohólicas aun en mínima cantidad. Además, se debería evitar, en lo
posible, las exposiciones prolongadas al sol. Si esto no fuera posible
se debería indicar protección. En el caso de Nifurtimox se recomienda no
conducir automóviles ni manejar artefactos de precisión durante el
tratamiento.
En mujeres en edad fértil habría que investigar la posibilidad de
embarazo previo al inicio del tratamiento e indicar la anticoncepción
durante el mismo. Se prefiere el uso de preservativo (y de ser posible
con espermicida), dado que no está estudiada la interacción de los
anticonceptivos orales con las drogas tripanocidas.
Se recomienda realizar 2 controles de laboratorio (hemograma, urea o
creatinina, y hepatograma): pretratamiento e intratratamiento (día
15-20). Además se debería realizar un examen de laboratorio ante la
presencia de eventos adversos que sugieran alteración en alguno de los
parámetros mencionados.
En el caso de pacientes trasplantados e inmunosuprimidos que cursan
reactivación o infección primaria transmitida por el órgano recibido y
evidencia clínico-histológica de rechazo, se recomienda continuar con el
tratamiento parasiticida y no suspender el tratamiento inmunosupresor.
En el caso de pacientes con infección por VIH con reactivación debería
iniciarse o adecuar el TARGA lo antes posible, adicionalmente a la
implementación del tratamiento tripanocida.
En el caso de áreas endémicas, antes de iniciar el tratamiento
etiológico debería interrogarse al paciente sobre la presencia de
triatominos (“vinchucas”) en el domicilio o peridomicilio. De no estar
asegurado el control entomológico en el área y si el cuadro clínico del
paciente lo permite, sería conveniente ponerse en contacto con las
autoridades provinciales responsables del control vectorial. Sin
embargo, este hecho no sería motivo para retrasar el tratamiento en
casos agudos.
4.1.4 Efectos adversos y su manejo
Los eventos adversos del tratamiento tripanocida son variables según la
droga utilizada. En general, la mayoría se presentaría entre los 15 y 30
días de iniciada la administración de fármaco. Se debería recordar que
la frecuencia e intensidad es mayor a medida que aumenta la edad de los
pacientes.
La mayoría de estos eventos serían leves a moderados y no requerirían
suspensión del tratamiento. Sin embargo, algunos eventos adversos
podrían ser graves, por lo que se debería explicar claramente al
paciente las pautas de alarma y realizar un seguimiento estrecho para
detectarlos precozmente y tomar conductas adecuadas. Entre los eventos
adversos más frecuentes observados con el tratamiento tripanocida pueden
mencionarse:
• Erupción cutánea de diverso tipo, principalmente con el uso de
benznidazol.
• Trastornos digestivos (náuseas, vómitos, diarrea, epigastralgia,
distensión abdominal).
• Síntomas generales: fiebre, artralgias, mialgias, fatiga, adenopatías.
• Fenómenos neurotóxicos periféricos y/o del sistema nervioso central
(cefalea, anorexia, irritabilidad, llanto persistente en lactantes,
insomnio, temblores, mareos, trastornos del estado de ánimo, pérdida del
equilibrio y la memoria, convulsiones, síntomas de neuropatía periférica
como hipo o hiperestesias, parestesias o dolor neuropático).
• Elevación de transaminasas mayor a 3 veces los valores máximos
normales con o sin síntomas de hepatitis.
• Eosinofilia.
• En el primer año de vida el tratamiento produce en algunos casos
estancamiento del crecimiento ponderal (principalmente con nifurtimox),
lo que no debe inducir a su suspensión.
Entre los efectos adversos graves (de baja frecuencia de aparición)
pueden mencionarse:
• Leucopenia por debajo de 2500/mm3 (a expensas de neutropenia)
• Plaquetopenia
• Síndrome de Stevens-Johnson (benznidazol)
La Figura 5 muestra la presentación de los distintos tipos de eventos
adversos y su momento de aparición:
La conducta frente a los eventos adversos dependería del tipo y la
gravedad en cada caso. En forma general, ante la aparición de efectos
adversos leves sería posible disminuir la dosis utilizada o suspender el
tratamiento transitoriamente mientras se efectúa tratamiento
sintomático. Una vez controlados los efectos adversos se podría
reinstalar la dosis óptima en forma gradual (en 3 días), asociando
siempre el tratamiento sintomático. En caso de reiteración de estos
signos de intolerancia o compromiso del estado general, se debería
suspender inmediatamente la administración de la droga en uso.
En el Anexo III se describe con más detalle el manejo clínico
recomendado para el control de los eventos adversos asociados al
tratamiento tripanocida. Ante la presencia de eventos adversos, los
mismos deben ser notificados al Sistema Nacional de Farmacovigilancia:
snfvg@anmat.gov.ar, www.anmat.gov.ar, Av. de Mayo 869, Piso 11, CP 1084,
CABA.
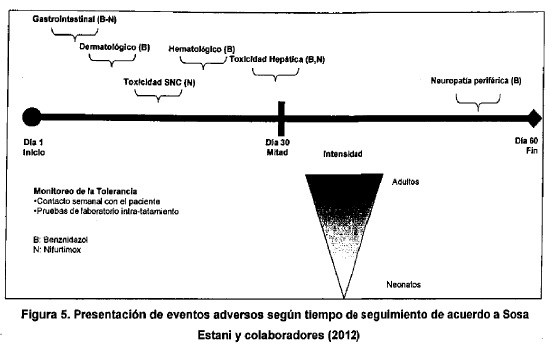
4.1.5 Controles posterapéuticos
Controles del tratamiento en fase aguda
En los pacientes que inician tratamiento durante la fase aguda con
parasitemia detectable se recomienda realizar control parasitológico
directo (Strout o micrométodos) entre los 15 y 20 días de iniciado el
tratamiento. Con una adecuada respuesta terapéutica, en ese momento la
parasitemia debería ser negativa. En caso de persistencia de parasitemia
positiva, evaluar si el tratamiento está siendo bien administrado, sobre
todo verificar la dosis, antes de pensar en posible resistencia de la
cepa infectante. En caso de parasitemia persistente que sugieran
resistencia de la cepa infectante a la droga en uso, habría que utilizar
la otra droga disponible según el esquema recomendado. En caso de
resultado parasitológico negativo continuar la administración hasta
completar los 60 días de tratamiento.
Se recomienda realizar pruebas serológicas que detectan IgG para el
control de la eficacia del tratamiento al finalizar el mismo y a los 6,
12, 24 y 48 meses.
|
• El criterio actual
de curación parasitológica sería la negativización de la
serología convencional.
• La negativización de la serología sería más precoz cuanto
menor es la edad del paciente que recibe el tratamiento. |
Controles del tratamiento en fase crónica
Luego de administrar el tratamiento en la fase crónica de la enfermedad,
se recomienda efectuar controles serológicos una vez por año, ya que si
bien la administración de la droga tendría la capacidad de eliminar al
parásito, la negativización de la serología ocurriría varios años
después.
La serología convencional, evaluada por lo menos con dos reacciones
diferentes, se negativizaría en diferentes períodos según el tiempo que
el paciente permaneció infectado hasta el comienzo del tratamiento.
Niños y jóvenes, así como adultos con infección reciente, negativizarían
la serología más rápido que cuando la infección tiene mayor antigüedad.
Cabe aclarar que hasta la actualidad el éxito terapéutico se confirmaría
con la negativización de la serología, mientras que el fracaso
terapéutico sólo se demostraría con la detección del parásito en sangre.
La serología reactiva posterior al tratamiento perdería su valor para
indicar una infección activa, y no implicaría necesariamente fracaso
terapéutico.
5. ACCIONES PREVENTIVAS SANITARIAS
5.1.1 Vigilancia epidemiológica
Los objetivos de la vigilancia epidemiológica en Enfermedad de Chagas
incluyen:
• Monitorear la tendencia de la transmisión;
• Alertar en forma temprana ante casos agudos vectoriales, a fin de
realizar las acciones de control correspondientes;
• Informar acerca del riesgo de transmisión congénita y posibilitar su
seguimiento;
• Registrar la prevalencia de infección en el grupo de embarazadas;
• Registrar la prevalencia en estudios poblacionales y permitir la
identificación y seguimiento de casos detectados;
• Registrar los casos positivos detectados a demanda para posibilitar su
seguimiento, especialmente en menores de 15 años;
• Registrar la prevalencia en el grupo de donantes de sangre;
• Unificar el registro y forma de notificación de la información de
Chagas generada por los laboratorios, sirviendo a los diferentes actores
involucrados.
Por ser una herramienta puesta al servicio de la acción sanitaria, el
sistema de vigilancia epidemiológica se debería caracterizar por ser
flexible y dinámico, pudiendo ser modificado en el tiempo de ser
necesario. Por tal motivo, especialmente ante el caso de identificación
de pacientes en fase aguda de la infección, o ante el diagnóstico de un
caso de Chagas congénito, se recomienda consultar siempre las normativas
vigentes para la vigilancia, dispuestas por el Sistema Nacional de
Vigilancia en Salud (areavigilanciamsal@gmail.com; 011-4379-9000 int.
4788), y el Programa Nacional de Chagas (infochagas@msal.gov.ar;
0351-426-4705 int. 120) (Ministerio de Salud 2010).
En relación a la denuncia de un paciente con infección aguda por T.
cruzi por vía vectorial, la misma se realiza a través del Sistema
Nacional de Vigilancia de la Salud (SNVS —Módulo de Vigilancia Clínica,
C2 y Módulo de Vigilancia Laboratorial, SIVILA—). Dado que en la
actualidad este sistema no cuenta con módulos ON-LINE que permitan
cargar la ficha epidemiológica del caso, la misma debe enviarse a las
autoridades provinciales responsables del control entomológico, o en su
defecto directamente al Programa Nacional de Chagas (infochagas@msal.gov.ar;
0351-426-4705 int. 120).
5.1.2 Vigilancia farmacológica
El perfil de seguridad del tratamiento tripanocida durante el embarazo
continúa siendo un punto a elucidar. Al respecto, estudios
experimentales con benznidazol en ratas y conejos no han detectado un
incremento del riesgo teratogénico con su uso. En cuanto a su
administración en humanos, sólo se han comunicado en forma aislada
algunos casos de gestantes que recibieron tratamiento con benznidazol,
sin que se presentaran efectos teratogénicos en la descendencia. A pesar
de ello, estos resultados no permitirían determinar con certeza la
seguridad del uso de benznidazol durante la gestación en seres humanos.
Por tal motivo, las mujeres en edad reproductiva que sean sexualmente
activas y que tengan indicación de tratamiento tripanocida, tendrían
además indicación de uso de métodos anticonceptivos en forma
concomitante durante el mismo, siendo de preferencia aquellos métodos de
barrera. Por otra parte, el tratamiento tripanocida en mujeres
embarazadas con infección por T. cruzi continuaría siendo una práctica
desaconsejada, salvo que la infección comprometa el estado de salud de
la gestante y ponga en riesgo su vida y/o la del futuro bebé
(contraindicación relativa).
A pesar de lo mencionado, sería posible que una mujer embarazada reciba
medicación tripanocida, ya sea porque tuviera un embarazo no detectado
al momento de iniciar el tratamiento, o porque quede embarazada luego de
iniciar el mismo, a pesar de las medidas indicadas. Cabe recordar al
respecto que una proporción significativa de los embarazos en nuestro
medio no son buscados, por lo que la exposición a medicamentos
potencialmente teratogénicos en etapas iniciales de la gestación no
sería un hecho infrecuente. En el Centro Nacional de Genética Médica del
ANLIS funciona el servicio de información sobre agentes teratogénicos
Línea Salud Fetal. En este servicio se reciben diariamente consultas
voluntarias respecto a gestantes expuestas a medicamentos potencialmente
teratogénicos y se realiza el seguimiento de las mismas. De esta forma
sería posible obtener información adicional que permita conocer mejor el
perfil de seguridad de estas drogas durante la gestación. Por tal
motivo, se recomienda que todo caso de una gestante que haya recibido
medicación tripanocida sea notificado a la Línea Salud Fetal (0800 444
2111, de lunes a viernes de 9 a 16 h, Av. Las Heras 2670 3er piso, CABA),
del Centro Nacional de Genética Médica-ANLIS, a fin de recibir
orientación sobre los controles obstétricos que sean necesarios realizar
y efectuar el seguimiento correspondiente.
Finalmente, se debe recordar que en Argentina existe un Sistema Nacional
de Farmacovigilancia, el cual está coordinado por la Administración
Nacional de Medicamentos, Alimentos y Tecnología Médica ANMAT. Dicho
sistema de vigilancia recibe, colecta y analiza en forma sistemática
todas las notificaciones voluntarias de potenciales eventos adversos
atribuibles al uso de medicamentos. Al respecto, se recomienda que todos
los potenciales eventos adversos atribuibles al tratamiento tripanocida
sean notificados en forma oportuna por las siguientes vías: snfvg@anmat.gov.ar,
www.anmat.gov.ar, Av. de Mayo 869, Piso 11, CP 1084, CABA.
5.1.3 Control de donantes en bancos de sangre y/o servicios de
hemoterapia
Ya se mencionó que una de las formas de contraer la infección por T.
cruzi es mediante la transfusión de sangre contaminada. Las indicaciones
para el control de sangre según las “Normas para el diagnóstico de la
infección por T. cruzi” establecen que además de los métodos descritos
en la sección Diagnóstico de fase crónica, los bancos de sangre podrán
utilizar dos métodos serológicos de selección o descarte (RSD). Estos
métodos permitirían identificar rápidamente los sueros reactivos,
ofreciendo la posibilidad de garantizar adecuadamente la seguridad de la
transfusión ante un donante no reactivo. Sin embargo, un resultado
reactivo que indica la necesidad de descartar la sangre del donante
podría incluir un porcentaje elevado de falsos positivos, por lo que en
ningún momento los resultados de estas pruebas de rastrillaje pueden
utilizarse para confirmar una infección crónica por T. cruzi. Por tal
motivo, todos los donantes cuya sangre presente resultados reactivos
deberían ser derivados al sistema de salud para realizar la confirmación
diagnóstica e iniciar el seguimiento y control médico si ésta se
confirma.
5.1.4 Orientación laboral
La Ley Nacional 26.281/07 (Ley sobre Enfermedad de Chagas) prohíbe la
realización del estudio de Chagas en el examen prelaboral. Los
individuos serológicamente reactivos, sin síntomas, con
electrocardiograma y radiología normales, no deberán ser restringidos en
su actividad laboral. Es decir que la serología reactiva por sí sola no
puede ser causa de inaptitud laboral, constituyendo éste un acto
discriminatorio según esta ley.
Los pacientes infectados y con cardiopatía sin cardiomegalia detectada
luego de una evaluación clínica-cardiológica, con reserva cardíaca
conservada al esfuerzo, que presenten:
• bloqueos intraventriculares avanzados (bloqueo de rama derecha o
hemibloqueos),
• disfunción sinusal,
• marcapasos cardíacos definitivos,
• cardiodesfibriladores,
• extrasistolia ventricular corregida por el tratamiento, y/o
• taquiarritmias,
podrían realizar actividades según indicación médica y deberían
exceptuarse del trabajo físico intenso o de actividades con riesgo para
terceros (aviadores, choferes, etc.).
Aquellos pacientes con arritmias refractarias, o con cardiomegalia
(relación cardiotorácica mayor de 0,50) sin signos de insuficiencia
cardíaca, sólo podrían desempeñar actividades sedentarias.
La presencia de insuficiencia cardíaca clínica excluiría el desempeño de
cualquier actividad laboral que requiera esfuerzo físico.
6. REFERENCIAS BIBLIOGRAFICAS
• Almeida IC, Pereira-Chioccola VL, Piovezam AG, Silsa LS, Velázquez E,
Fragata AA, Segura EL, Sosa Estani S, Travassos LR. Criterium of
serological cure in treated chronic chagasic patients by
chemoluminiscent immunoassay using Trypanosoma cruzi trypomastigote
mucins. Medicina (Buenos Aires) 1999, 59 (Supl III):16.
• Altcheh J, Corral R, Biancardi MA, Freilij H. Anti-F2/3 antibodies as
cure marker in children with congenital Trypanosoma cruzi infection.
Medicina (B Aires); 63(1): 37-40, 2003.
• Altcheh J, Moscatelli G, Moroni S, Garcia-Bournissen F, Freilij H.
Adverse events after the use of benznidazole in infants and children
with Chagas disease. Pediatrics 2011; 127(1): e212-8.
• Alvarez M, Cerisola JA, Rohweder RW, 1968. Test de inmunofluorescencia
para el diagnóstico de la enfermedad de Chagas. Bol. Chil. Parasitol.,
23:4.
• Andrade SG, Stocker-Guerret S, Pimentel AS, Grimaud JA. Reversibility
of cardiac fibrosis in mice chronically infected with Trypanosoma cruzi,
under specific chemotherapy. Mem Inst Oswaldo Cruz 1991; 86, 187-200.
• Anónimo. Pautas para la prevención de infecciones oportunistas en
personas con VIH o SIDA en América Latina y el Caribe. USPHS/IDSA Bol.
Oficina Sanit Panam 1996; 121: 377-403.
• Atkins D, Best D, Briss PA, Eccles M, et al. Grading quality of
evidence and strength of recommendations. BMJ 2004; 328(7454): 1490.
• Barclay CA, Cerisola JA, Lugones H, Ledesma O, Lopez Silva J & Mouzo
G. Aspectos farmacológicos y resultados terapéuticos del benznidazol en
el tratamiento de la infección chagásica. La Prensa Médica Argentina
1978; 65 (7): 239-244.
• Bergoglio R, 1984. Enfermedad de Chagas post-transfusional.
Experiencia clínica en 48 casos. Prensa Med Arg 71(2). 49.
• Blanco SB, Segura EL, Cura EN, Chuit R, Tullan L, Flores I, Garbarino
G, Villalonga JF, Gürtler RE.
• Trop Med Int Health. Congenital transmission of Trypanosoma cruzi: an
operational outline for detecting and treating infected infants in
north-western Argentina. 2000 Apr; 5(4):293-301.
• Blanco S, Spillman C, Zarate J, Flores I, Medina J, Sosa Estani S,
1997. Tratamiento y seguimiento de 147 niños de 1 a 14 años, infectados
por T. cruzi, en el área rural del departamento Pellegrini, en
vigilancia entomológica. Santiago del Estero, Argentina. Medicina
(Buenos Aires), 57 Supl III:43-44.
• Bocchi EA, Fiorelli A. The paradox of survival results after heart
transplantation for cardiomyopathy caused by Trypanosoma cruzi. Ann
Thorac Surg, 2001;71:1833-1838.
• Britto C, Cardoso A, Silveira C, Macedo V, Fernandes O. Polymerase
chain reaction (PCR) as a laboratory tool for the evaluation of the
parasitological cure in Chagas disease after specific treatment.
Medicina (B Aires) 1999;59 (Suppl) 2:176-8.
• Britto C, Silveira C, Cardoso MA, Marques P, Luquetti A, Macedo V,
Fernandes O. Parasite persistence in treated chagasic patients revealed
by xenodiagnosis and polymerase chain reaction. Mem Inst Oswaldo Cruz
2001;96(6):823-6.
• Cançado R. Capítulo: Terapéutica específica, 1997, p. 323-351. En
Clínica e terapêutica da Doença de Chagas. Uma abordagem prática para o
clínico geral. Pinto Dias J, Rodriguez Coura J, Ed FIOCRUZ.
• Caravalho VB de, Sousa EFL, Vila JHA, et al. Heart transplantation in
Chagas’ disease 10 years after the initial experience. Circulation
1996;94:1815-1817.
• Cerisola JA, Alvarez M, Wynne de Martini GJ, Bonacci H. La reacción de
hemoaglutinación cualitativa para el diagnóstico de la enfermedad de
Chagas. Bioq Clin 1971;5:94.
• Chuit R, Paulone I, Wisnivesky-Colli C, Bo R, Perez AC, Sosa Estani S,
Segura EL. Result of a first step toward community-based surveillance of
transmission of Chagas’ disease with appropriate technology in rural
areas. Am J Trop Med Hyg 1992;46(4):444-450.
• Consejo de Enfermedad de Chagas Dr. Salvador Mazza. Consenso sobre
Enfermedad de Chagas - Mazza. Buenos Aires: Sociedad Argentina de
Cardiología, 2011.
• Coura JR, de Abreu LL, Willcox HP, Petana W. Comparative controlled
study on the use of benznidazole, nifurtimox and placebo, in the chronic
form of Chagas disease, in a field area with interrupted transmission.
I. Preliminary evaluation. Rey Soc Bras Med Trop 1997; 30: 139-144.
• Cura EN, Ruiz AM, Velazquez E, Malagrino N, Orn A, Segura EL.
Estandarización de un kit de confirmación (FATALAKIT) para el
inmunodiagnóstico de la infección por el Trypanosoma cruzi. Medicina
(Buenos Aires) 1993;53:82.
• Cura EN, Wendel S y col. Manual de Procedimientos de Control de
Calidad para los Laboratorios de Serología de los Bancos de Sangre. De,
PAHO/HPC/HCT/94.21, OPS, 1994.
• de Andrade ALS, Zicker F, de Oliveira RM, Almeida y Siva S, Luquetti
A, Travassos LR, Almeida IC, de Andrade SS, de Andrade JG, Martelli CMT.
Randomised trial of efficacy of benznidazole in treatment of early
Trypanosoma cruzi infection. The Lancet 1996; 348:1407-1413.
• Hasslocher-Moreno AM, do Brasil PE, de Sousa AS, Xavier SS, Chambela
MC, Sperandio da Silva GM. Safety of benznidazole use in the treatment
of chronic Chagas’ disease. J Antimicrob Chemother. 2012
May;67(5):1261-6. De Rissio AM, Cura E, Esteva M, Sosa Estani S, Segura
EL, y col. Manual de Laboratorio. Enfermedad de Chagas y otras
Parasitosis. Instituto Nacional de Chagas “Dr. Mario Fatala Chaben”,
Ministerio de Salud y Acción Social de la Nación, 8va Edición, 1996.
• De Rissio AM, Riarte AR, Martín García M, Esteva MI, Quaglino M, Ruiz
AM. Congenital Trypanosoma cruzi Infection. Efficacy of lts Monitoring
in an Urban Reference Health Center in a Non-Endemic Area of Argentina.
Am J Trop Med Hyg 2010; 82(5): 838-845
• del Barco M, Streiger M, Arias E, Fabro D, Amicone N. Respuesta al
tratamiento en niños con infección chagásica crónica. Medicina (Buenos
Aires) 1993;53 (Supl. l):78.
• Doval H, Tajer C. Evidencias en Cardiología III (2004) De los ensayos
clínicos a las conductas terapéuticas. Schapachnik E, Villar JC, Freilij
H y Altcheh J. Tratamiento de la enfermedad de Chagas Cap.16
Pág.378-380.
• Fabbro DL, Streiger ML, Arias ED, Bizai ML, del Barco M, Amicone NA.
Trypanocide treatment among adults with chronic Chagas disease living in
Santa Fe city (Argentina), over a mean follow-up of 21 years:
parasitological, serological and clinical evolution. Rev Soc Bras Med
Trop. 2007 Jan-Feb;40(1): 1-10.
• Fabro D, Arias E, Streiger M, Piacenza M, Ingaramo M, Del Barco M et
al. Evolutive behavior towards cardiomyopathy of treated (nifurtimox or
benznidazole) and untreated chronic chagasic patients. Rev Inst Med Trop
S Paulo 2000; 42:99-109.
• Ferreira MS, Nishioka SA, Silvestre MT, et al. Reactivation of Chagas’
disease in patients with AIDS: report of three new cases and review of
the literature. Clin Infect Dis 1997;25:1397-400
• Fragata Filho AA, Boianain E, Silva MAD, Correia EB, Borges Filho R,
Martins C, Salene V, Batlouni M, Souza E. Validade do tratamiento
etiológico da fase crônica da doença de Chagas com benznidazol. Arq Bras
Cardiol 1995; 65 (Supl I): 71.
• Freilij H, Altcheh J, Muchinik G. Perinatal human immunodeficiency
virus infection and congenital Chagas’ disease. Pediatr Infect Dis J.
1995 Feb;14(2):161-2.
• Freilij H, Altcheh J. Congenital Chagas’ disease: diagnostic and
clinical aspects. Clin Infect Dis. 1995;21(3):551-5.
• Freilij H, Muller L, Gonzales Cappa S. Direct Micromethod for
diagnosis of Acute and congenital Chagas Disease. J Clin Microbiol
1983;18(2):327-330.
• Gallerano. R, Sosa R. Resultados de un estudio a largo plazo con
drogas antiparasitarias en infectados chagásicos crónicos. Rev Fed Arg
Cardiol 2001; 30: 289-296.
• Galvao LMC Nunes RMB Cançado JR and Krettli. Lytic antibody as a means
of assessimg cure after treatment of Chagas diasease: a 10 years
follow-up study. Trans R Soc trop Med Hyg 1993;87:220-223.
• Gazzinelli RT, Galvao LM, Krautz G, Lima PC, Cancado JR, Scharfstein
J, Krettli AU. Use of Trypanosoma cruzi purified glycoprotein (GP57/51)
or trypomasrigote-shed antigens to asses cure for human Chagas’ disease.
Am J Trp Med Hyg 1993;49(5):625-635.
• González Zuelgaray J. Arritmias ventriculares en la enfermedad de
Chagas. Rev Col Arg Cardiol 2001;5:14.
• GRADE The Grading of Recommendations Assessment, Development and
Evaluation. Working group. Acceso:
http://www.gradeworkinggroup.org/es/index.htm. Ultimo accceso 12/7/13.
• Gurtler RE, Segura EL, Cohen JE. Congenital transmission of
Trypanosoma cruzi infection in Argentina. Emerg Infect Dis
2003;9(1):29-32,.
• Houghton RL, Benson DR, Reynolds L, McNeill P, Sleath P, Skeily YA,
Badaro R, Krettli AU, Reed SC Multiepitope synthetic peptide and
recombinant protein for the detection of antibodies to Trypanosoma cruzi
in patients with treated Chagas’ disease. J Infect Dis 2000;
181(1):325-30.
• lanni BM, Arteaga E, Mady C, Barretto ACP, Pileggi F. Uso de
benznidazol em chagásicos na forma indeterminada: Resultados a longo
prazo. Arq Bras Cardiol 1993; 61 (Supl II): 130.
• Jackson Y, Alirol E, Getaz L, Wolff H, Combescure C, Chappuis F.
Tolerance and safety of nifurtimox in patients with chronic chagas
disease. Clin Infect Dis. 2010, Nov 15;51(10):e69-75.
• Krautz GM, Galvao LMC, Cancado JR, Guevara-Espinoza A, Ouaissi A,
Krettli AU. Use of a 24- Kilodalton Trypanosoma cruzi Recombinant
Protein to Monitor Cure of Human Chagas’ Disease. J Clin Microbiol
1995;33(8):2086-2090.
• Krettli AU, Cançado JR, Brener Z. Criterion of cure of human Chagas’
disease after specific chemotherapy, recent advances. Mem Ins Oswaldo
Cruz 1984; 79:157-164.
• Laucella SA, Mazliah DP, Bertocchi G, Alvarez MG, Cooley G, Viotti R,
et al Changes in Trypanosoma cruzi-specific immune responses after
treatment: surrogate markers of treatment efficacy. Clin Infect Dis.
2009 Dec 1;49(11):1675-84.
• Laucella SA, Postan M, Martin D, Hubby Fralish B, Albareda MC, Alvarez
MG, Lococo B, Barbieri G, Viotti RJ, Tarleton RL. Frequency of
interferon- gamma -producing T cells specific for Trypanosoma cruzi
inversely correlates with disease severity in chronic human Chagas
disease. Infect Dis;189(5):909-18, 2004.
• Laucella SA, Sgura EL, Riarte A, Sosa Estani S. Soluble platelet
selectin (s-P-Selectin) and soluble vascular adhesion molecule-1
(s-VCAM-1). Decrease during therapy with benznidazole in children with
lndeterminate form of Chagas’ disease. Clin Exp Immunol
1999;118:423-427.
• Lauria-Pires L, Braga MS, Vexenat AC, et al. Progressive chronic
Chagas’ heart disease ten years after treatment with anti-Trypanosoma
cruzi nitroderivatives. Am J Trop Med Hyg 2000; 63: 111-8.
• Lausi I. Involvement of the digestive tract in chagas disease. Rev
Asoc Med Argent 1964;78:159-62.
• Lazzari JO, Pereira M, Antunes CM, Guimaraes A, Moncayo A, Chavez
Domínguez R, Hernandez Pieretti O, Macedo V, Rassi A, Maguire J, Romero
A. Diagnostic electrocardiography in epidemiological studies of Chagas’
disease: multicenter evaluation of a standardized method. Rev Panam
Salud Publica 1998;4(5):317-30.
• Lugones H. Actualización terapéutica. Tratamiento de la Enfermedad de
Chagas Agudo en niños. Pediatría 1978; 2:103-105
• Mallimaci MC, Sijvarger C, Dates A, Alvarez M, Sosa-Estani S.
Seroprevalencia de la enfermedad de Chagas en Ushuaia, Argentina, una
zona son triatominos. Rev Panam Salud Pública 2001;9(3):169-171.
• Mallimaci MC, Sosa-Estani S, Russomando G, Sanchez Z, Sijvarger C,
Alvarez IM, Barrionuevo L, Lopez C, Segura EL. Early diagnosis of
congenital Trypanosoma cruzi infection, using shed acute phase antigen,
in Ushuaia, Tierra del Fuego, Argentina. Am J Trop Med Hyg. 2010
Jan;82(1):55-9.
• Marin-Neto JA, Rassi A Jr, Morillo CA, Avezum A, Connolly SJ,
Sosa-Estani S, Rosas F, Yusuf S; BENEFIT Investigators. Rationale and
design of a randomized placebo-controlled trial assessing the effects of
etiologic treatment in Chagas’ cardiomyopathy: the BENznidazole
Evaluation For Interrupting Trypanosomiasis (BENEFIT). Am Heart J. 2008
Jul;156(1):37-43.
• Ministerio de Salud de la Nación. Guías para la Atención del Paciente
Infectado por Trypanosoma cruzi. Buenos Aires: Resolución 1870/06,
Ministerio de Salud de la Nación, 2006.
• Ministerio de Salud de la Nación. Normas para el diagnóstico de la
infección por T. cruzi. Buenos Aires: Ministerio de Salud de la Nación,
2012.
• Ministerio de Salud de la Nación. Plan 2011-2016 para el control de la
Enfermedad de Chagas en Argentina. Buenos Aires: Programa Nacional de
Chagas, Ministerio de Salud de la Nación (Boletín oficial 32426, Res
867/12), 2010.
• Ministerio de Salud de la Nación. Enfermedad de Chagas: Normativa y
tutorial para la vigilancia a través del Sistema Nacional De Vigilancia
Laboratorial (SIVILA-SNVS). Actualización 2010. Buenos Aires: Ministerio
de Salud de la Nación, 2010.
• Mitelman JE, Descalzo A, Giménez L, Pesce R, Romero Villanueva H,
Auger S. Consenso de Enfermedad de Chagas-Mazza. Rev Argent Cardiol
2011;79: 544-64
• Moya PR, Paolasso RD, Blanco S, Lapasset M, Sanmartino C, Baso B,
Moretti E, Cura D, 1985. Tratamiento de la Enfermedad de Chagas con
Nifurtimox durante los primeros meses de vida. Medicina (Buenos Aires)
45:553-558.
• Nishioka SA. Benznidazol na quimioprofilaxia primária da reativação de
doença de Chagas em chagásicos crônicos em uso de corticosteróides em
doses imunodepressoras: há evidência suficiente para a recomendação do
seu uso Rev Soc Bras Med Trop 2000;33:83-5.
• Organización Panamericana de la Salud/Organización Mundial de la
Salud. OPS/HCP/HCT/140/99.
Tratamiento Etiológico de la Enfermedad de Chagas. Conclusiones de una
Consulta Técnica, 1999
• Pereira-Chioccola VL, Fragata-Filho AA, Levy AM, Rodrigues MM,
Schenkman S. Enzyme-linked immunoassay using recombinant trans-sialidase
of Trypanosoma cruzi can be employed for monitoring of patients with
Chagas’ disease after drug treatment. Clin Diagn Lab lmmunol
2003;10(5):826-30.
• Perez-Molina JA, Perez-Ayala A, Moreno S, Fernandez-Gonzalez MC,
Zamora J, Lopez-Velez R. Use of benznidazole to treat chronic Chagas’
disease: a systematic review with a meta-analysis. J Antimicrob
Chemother. 2009 Dec;64(6):1139-47.
• Pinazo MJ, Munoz J, Posada E, Lopez-Chejade P, Gallego M, Ayala E, et
al. Tolerance of benznidazole in treatment of Chagas’ disease in adults.
Antimicrob Agents Chemother. 2013 Nov;54(11):4896-9.
• Rassi A Jr. Predictors of Mortality in Chronic Chagas Disease A
Systematic Review of Observational Studies. Circulation
2007;115:1101-1108
• Remesar MC, Gamba C, Colaianni IF, Puppo M, Sartor PA, Murphy EL,
Neilands TB, Ridolfi MA, Leguizamón MS, Kuperman S, Del Pozo AE.
Estimation of sensitivity and specificity of several Trypanosoma cruzi
antibody assays in blood donors in Argentina. Transfusion. 2009 Nov;
49(11):2352-8.
• Reyes PA, Vallejo M. Trypanocidal drugs for late stage, symptomatic
Chagas disease (Trypanosoma cruzi infection). Cochrane Database Syst
Rev. 2005(4):CD004102.
• Rezende JM. O aparelho digestivo na doença de Chagas: Aspectos
clínicos. In Clínica e terapêutica da doença de Chagas. Uma abordagem
prática para o clínico geral. ED Dias JCP, Coura JR. Editora FIOCRUZ,
Río de Janeiro 1997.
• Riarte A, Luna C, Sabatiello R, et al Chagas’ disease in patients with
kidney transplants: 7 years experience, 1989-1996. Clin infect bis,
1999;29: 561-567.
• Rosembaum M, Cerisola JA. Epidemiología de la Enfermedad de Chagas. “O
hospital” 1961; 60(1):75-123.
• Sackett DL, Rosenberg WM. The need for evidence-based medicine. J R
Soc Med 1995; 88: 620-624.
• Sackett DL. Evidence Based Medicine. How to practice and to teach EBM.
Churchill Livingstone 1997.
• Sartori AMC, Sotto MN, Braz LMA, et al. Reactivation of Chagas’
disease manifested by skin lesions in a patient with AIDS. Trans R Soc
Trop Med Hyg 1999;93:631-2.
• Schijman AG, Altcheh J, Burgos JM, Biancardi M, Bisio M, Levin MJ,
Freilij H. Aetiological treatment of congenital Chagas’ disease
diagnosed and monitored by the polymerase chain reaction. J Antimicrob
Chemother 2003;52(3):441-9.
• Segura EL, Cura EN, Sosa Estani S, Andrade J, Lansetti JC, De Rissio
AM, Campanini A, Blanco S, Gürtler R, Alvarez M. Long-term effects of a
Nation-wide control program on the seropositivity for Trypanosoma cruzi
infection in young men from Argentina. Am J Trop Med Hyg
2000;62(3):353-362.
• Sociedad Argentina de Infectología. Evaluación infectológica para
donantes de órganos sólidos. 2007.
http://www.sadi.org.ar/files/EVALUACIONINFECTOLOGICADONANTESADI.pdf
• Sociedad Argentina de Infectología. Prevención de Infecciones en
Pacientes Receptores de Trasplante de Células Hematopoyéticas. 2011.
http://www.sadi.org.ar/files/Prevenci%C3%B3n%20de%20Infecciones%20en%20Ptes%20Receptores%20de%20Tx%20
de%20C%C3%A9lulas%20Hematopoy%C3%A9ticas_final.pdf
• Solari A, Ortiz S, Soto A, Arancibia C, Campillay R, Contreras M,
Salinas P, Rojas A, Schenone H. Treatment of Trypanosoma cruzi-infected
children with nifurtimox: a 3 years follow-up by PCR. J Antimicrob
Chemother 2001, 48(5)515-9.
• Sosa Estani S, Segura EL, Ruiz AM, Velazquez E, Porcel B, Yampotis C.
Chemotherapy with benznidazole in children in undetermined phase of
Chagas Disease. Am J Trop Med Hyg 1998;59(4):526-529.
• Sosa Estani, S, Segura EL, Cura E, Velazquez E, Prado N. Evolución
clínica y serológica en niños en fase indeterminada de la infección por
Trypanosoma cruzi, tratados con Benznidazol. Seguimiento de 7 años.
Medicina (Buenos Aires) 1999, 59(Supl III): 17-18.
• Sosa-Estani S, Armenti A, Araujo G, Viotti R, Lococo B, Ruiz Vera B,
Vigliano C, De Rissio AM, Segura EL. Tratamiento de la Enfermedad de
Chagas con Benznidazol y Acido Tióctico. Medicina (Buenos Aires)
2004;64:1-6.
• Sosa-Estani S, Cura E, Velazquez E, Yampotis C, Segura EL. Etiological
treatment of young women infected with Trypanosoma cruzi, and prevention
of congenital transmission. Rev Soc Bras Med Trop. 2009
Sep-Oct;42(5):484-7.
• Sosa Estani S, Colantonio L, Segura E. Therapy of Chagas Disease:
implications for Levels of Prevention. Journal of Tropical
Medicine.Volume 2012 (2012), Anide ID 292138, 10 pages.
doi:10.1155/2012/292138.
• Streiger ML, del Barco ML, Fabbro DL, Arias ED, Amicone NA.. Estudo
longitudinal e quimioterapia especifica em criancas, com doenca de
Chagas cronica, residentes em area de baixa endemicidade da Republica
Argentina. Rev Soc Bras Med Trop 2004;37(5):365-375.
• Villar JC, Marin-Neto JA, Ebrahim S, Yusuf S. Trypanocidal drugs for
chronic asymptomatic Trypanosoma cruzi infection. Cochrane Database Syst
Rev. 2002(1):CD003463.
• Viotti R, Vigliano C, Alvarez MG, Lococo B, Petti M, Bertocchi G, et
al, Impact of aetiological treatment on conventional and multiplex
serology in chronic Chagas disease. PLoS Negl Trop Dis. Sep;5(9):e1314.
• Viotti R, Vigliano C, Armenti A, Segura EL. Treatment of chronic
Chagas’ disease with benznidazole: Clinical and serologic evolution of
patients with long-term follow-up, 1994. American Heart Journal,
127(1):151-161.
• Viotti R, Vigliano C, Lococo B, Alvarez MG, Petti M, Bertocchi G, et
al. Side effects of benznidazole as treatment in chronic Chagas disease:
fears and realities. Expert Rev Anti Infect Ther. 2009 Mar;7(2):157-63.
• Viotti R, Vigliano C, Lococo B, Bertocchi G, Petti M, Alvarez MG, et
al. Long-term cardiac outcomes of treating chronic Chagas disease with
benznidazole versus no treatment: a nonrandomized trial. Ann lntern Med.
2006 May 16;144(10):724-34.
• Voller A. Microplateenzyme-linked immunosorbent assay for Chagas’
disease. Lancet 1975;i:426-428.
• Zayas CF, Perlino C, Caleindo A, et al. Chagas disease after organ
transplantation - United States, 2001. MMWR, 2002; 51(10):210-212.
7. ANEXO I. Historia clínica del paciente infectado por T. cruzi con
tratamiento tripanocida
8. ANEXO II. Manejo de la lesión visceral cardiológica por Enfermedad de
Chagas.
A continuación se reproducen los capítulos correspondientes al manejo de
arritmias y miocardiopatía dilatada del Consenso sobre Enfermedad de
Chagas - Mazza del Consejo de Enfermedad de Chagas Dr. Salvador Mazza,
de la Sociedad Argentina de Cardiología (2011).
ARRITMIAS EN LA ENFERMEDAD DE CHAGAS
En esta sección se tratan los trastornos electrocardiográficos
relacionados con la enfermedad de Chagas fuera del período agudo.
METODOLOGIA DE ESTUDIO
• Detectado un paciente con serología reactiva se deberá establecer cuál
es el grado de enfermedad cardíaca.
El valor de la ecocardiografía y Doppler en la enfermedad de Chagas con
arritmias (Clase I con Nivel de Evidencia A) radica en:
1. Detección precoz de alteraciones de los diámetros ventriculares y su
posterior seguimiento en la etapa subclínica de la enfermedad.
2. Determinación de la función sistólica y diastólica.
3. Establecer alteraciones de motilidad parietal con zonas de
hipocinesia, aquinesia y/o disquinesia.
4. Detección de aneurismas ventriculares y trombos intracavitarios.
5. Presencia de derrame pericárdico.
• Ergometría (Clase I con Nivel de Evidencia A)
Se analiza:
1.- Existencia de trastornos de conducción intraesfuerzo o en el período
de recuperación (aurículoventriculares y/o intraventriculares),
2.- detección de arritmias auriculares y ventriculares,
3.- determinación de la capacidad funcional,
4.- evaluación del cronotropismo,
5.- comportamiento de la presión arterial.
• ECG dinámico sistema Holter 24 h (Clase I con Nivel de Evidencia A)
• ECG de señal promediada (potenciales ventriculares tardíos) (Clase IIb
nivel de evidencia C)
Estudio electrofisiológico (Clase IIa nivel de evidencia C)
Permite investigar:
1.- Función del nódulo sinusal
2.- Conducción intrauricular
3.- Conducción aurículo ventricular e intraventricular
4.- Arritmias y su mecanismo
Exploración del sistema nervioso autónomo (Clase I nivel de evidencia C)
• Maniobra postural activa
• Prueba de hiperventilación
• Maniobra de Valsalva
• Tilt Test
PERIODO CRONICO CON TRASTORNOS ELECTROCARDIOGRAFICOS
ESTUDIOS COMUNES A TODOS LOS TRASTORNOS DEL RITMO CARDIACO
Clase I Nivel de Evidencia A
1.- Interrogatorio. Con especial atención en la sintomatología, hora del
día en que se produjeron los síntomas, posición (de pie, supina, etc.),
situación en que éstos ocurrieron, (reposo, esfuerzo, relación sexual,
etc.), situaciones psicológicas, etc. Evaluación de la acción
medicamentosa y posibles efectos adversos.
2.- Examen semiológico completo. Frecuencia cardíaca. Variación
inspiratoria y espiratoria. Posición acostado y de pie.
3.- Laboratorio de rutina incluyendo hormonas tiroideas.
4.- ECG convencional de 12 derivaciones. Maniobras bradi y
taquicardizantes (compresión seno carotídeo, maniobra de Valsalva,
estrés arritmético, ejercicio isométrico)
5.- Registro electrocardiográfico continuo sistema Holter. Variabilidad
de la frecuencia cardíaca
6.- Rx Tele tórax (frente y perfil).
7.- Ecocardiograma M, bidimensional y Doppler
Clase II
1.- Estudios radioisotópicos (Nivel de Evidencia B)
2.- ECG de señal promediada (Nivel de evidencia C)
3.- Sistemas de monitoreo implantable. Ante síncope recurrente y/o con
traumatismos, con causa no demostrada con los estudios previos. (Nivel
de Evidencia C)
DISFUNCION DEL NODULO SINUSAL (Estudios específicos)
Se agregan a los estudios generales
Clase I Nivel de Evidencia A
1.- Pruebas farmacológicas (atropina, isoproterenol)
2.- Estudio electrofisiológico. Indicado cuando existe discordancia
entre síntomas y resultados de los estudios previos.
TRASTORNOS DE CONDUCCION AURICULO-VENTRICULAR E INTRAVENTRICULAR
Clase I Nivel de evidencia A
1.- Estudio electrofisiológico. Indicado cuando existe discordancia
entre síntomas y resultados de los estudios previos.
TAQUICARDIA VENTRICULAR
Se agregan a los estudios generales
Clase I Nivel de Evidencia A
1.- Estudios radioisotópicos
2.- Cinecoronariografía
3.- Estudio electrofisiológico con inducción de la arritmia si se
plantea la duda con respecto a la arritmia padecida o se piensa en
indicar ablación transcatéter
Clase IIb nivel de evidencia C
1.- ECG de alta resolución, señal promediada, variabilidad de la
frecuencia cardíaca
2.- Biopsia endomiocárdica
3.- Resonancia magnética nuclear
TRATAMIENTO
Las arritmias y la insuficiencia cardíaca son dos aspectos que gobiernan
la evolución de los pacientes afectados con enfermedad de Chagas en la
etapa crónica.
1) Indicación de implante de marcapasos definitivo en pacientes con
trastornos de conducción severos y/o enfermedad del nódulo sinusal.
2) Tratamiento farmacológico o no farmacológico de las arritmias
ventriculares (TVS y/o TVNS).
3) Tratamiento eléctrico de la insuficiencia cardíaca (ver insuficiencia
cardíaca)
DISFUNCION DEL NODULO SINUSAL
La indicación principal para esta condición es el implante de marcapasos
definitivo.
Indicación de marcapasos
Clase I
1.- Disfunción del nódulo sinusal irreversible, espontánea o inducida
por fármacos necesarios e insustituibles, con síncopes, presíncopes o
mareos y/o insuficiencia cardíaca relacionados a la bradicardia. (Nivel
de Evidencia A)
2.- Síndrome bradi-taqui sintomático. (Nivel de Evidencia A)
3.- Bradi-taquiarritmia asintomática que requiere tratamiento
antiarrítmico agregado. (Nivel de Evidencia B)
4.-. Intolerancia A los esfuerzos claramente relacionada con
incompetencia cronotrópica. (Nivel de Evidencia B)
5.- Síndrome bradi-taqui con arritmias auriculares paroxísticas y alta
respuesta ventricular no controlables con tratamiento medicamentoso se
indica ablación del nódulo AV previo al implante de marcapasos. (Nivel
de Evidencia B)
Clase II
Disfunción del nódulo sinusal asintomática con incompetencia
cronotrópica con frecuencia menor a 40 latidos por minuto en vigilia.
(Nivel de Evidencia B)
Bradiarritmia sinusal que desencadena o agrava una insuficiencia
cardíaca, angina de pecho o taquiarritmia (Nivel de Evidencia B)
Clase III
Disfunción del nódulo sinusal en pacientes asintomáticos. (Nivel de
Evidencia B)
Disfunción del nódulo sinusal con síntomas independientes de la
bradicardia. (Nivel de Evidencia B)
Recomendaciones para la indicación del modo de estimulación Clase I
1.- DDD/R si existe bloqueo AV avanzado (Nivel de Evidencia A)
2.- AAI/R con reversión automática a DDD/R si existe bloqueo AV avanzado
intermitente (Nivel de Evidencia B)
Clase IIb
1.- VVI/R en ancianos en ausencia de conducción ventrículo atrial (Nivel
de Evidencia B)
2.- AAI/R en presencia de conducción aurículoventricular e
intraventricular normales. (Nivel de Evidencia A)
Clase III
1.- VVI/R, VDD/R en presencia de conducción retrógrada ventrículo atrial
(Nivel de Evidencia C)
2.- AAI/R en presencia de bloqueo AV avanzado (Nivel de Evidencia C)
Recomendaciones para activar la respuesta en frecuencia
De acuerdo a la cardiopatía, enfermedades asociadas y estilo de vida
BLOQUEOS AURICULO VENTRICULARES
Ante la indicación de marcapasos y para establecer la modalidad de
estimulación, debe tenerse en cuenta existencia de arritmias asociadas,
fracción de eyección del ventrículo izquierdo, calidad de vida,
condición física del paciente y necesidad de mantener la sincronía AV.
Bloqueo AV de primer grado
Clase I
1.- Bloqueo AV de primer grado irreversible con mareos, presíncope o
síncope cuyo estudio electrofisiológico muestra una localización infra o
infrahisiano y agravamiento del mismo por estimulación auricular o test
farmacológico. (Nivel de Evidencia B)
Bloqueo AV de segundo grado
Clase I
1.- Bloqueo AV de 2do grado sintomático permanente o intermitente,
irreversible o provocado por drogas necesarias o insustituibles
independiente del tipo de localización con síntomas definidos de bajo
flujo cerebral o insuficiencia cardíaca a consecuencia de bradicardia
(Nivel de Evidencia B).
2.- Bloqueo AV de 2do grado tipo Mobitz II sintomático con QRS angosto
(Nivel de Evidencia B).
3.- Bloqueo AV de 2do grado irreversible, asintomático, asociado a
arritmias ventriculares que necesitan tratamiento con fármacos
depresores de la conducción (Nivel de Evidencia B).
Clase II
1.- Bloqueo AV de 2do grado asintomático, permanente o intermitente
(Nivel de Evidencia B).
2.- Bloqueo AV de 2do grado tipo Mobitz II con QRS angosto,
asintomático, permanente o intermitente (Nivel de Evidencia B).
Clase III
1.- Bloqueo AV de 2do grado tipo I asintomático con aumento de la
frecuencia cardíaca y mejoría de la conducción AV con el ejercicio
físico y/o atropina endovenosa (Nivel de Evidencia B)
Bloqueo AV de tercer grado
Clase I
1.- Bloqueo AV completo sintomático, permanente o intermitente e
irreversible (Nivel de Evidencia A).
2.- Bloqueo AV completo asintomático, irreversible, de localización
intra o infrahisiana y con ritmo de escape intraventricular críticamente
lento (Nivel de Evidencia A).
3.- Bloqueo AV completo asintomático, irreversible con QRS angosto, con
arritmias ventriculares que necesitan antiarrítmicos depresores del
automatismo (Nivel de Evidencia B).
4.- Bloqueo AV completo adquirido, irreversible, asintomático con
frecuencia cardíaca inferior a 40 latidos por minuto durante períodos de
vigilia, sin incremento durante la actividad diaria (Nivel de Evidencia
A).
5.- Bloqueo AV completo irreversible, asintomático con períodos
documentados de asistolia mayores a 3 segundos en período de vigilia
(Nivel de Evidencia A).
6.- Bloqueo AV completo irreversible, asintomático con cardiomegalia
progresiva (Nivel de Evidencia B)
7.- Bloqueo AV completo irreversible, permanente o intermitente como
consecuencia de una ablación del nódulo AV (Nivel de Evidencia A).
Clase III
1.- Bloqueo AV completo transitorio por acción medicamentosa o química o
cualquier otra causa reversible.
Recomendaciones para la indicación del modo de estimulación
Clase I
1.- DDD/R con disfunción del nódulo sinusal y aurícula estable (Nivel de
Evidencia A).
2.- DDD/R con conducción ventrículo atrial retrógrada (Nivel de
Evidencia B).
3.- VVI/R con fibrilación auricular permanente (Nivel de Evidencia B).
Clase II
VDD con función sinusal normal (Nivel de Evidencia B).
Clase III
AAI/R o VVI/R con conducción retrógrada ventrículo atrial (Nivel de
Evidencia B).
VDD con disfunción del nódulo sinusal (Nivel de Evidencia B).
BLOQUEO INTRAVENTRICULAR
El bloqueo completo de rama derecha (BCRD) sólo o asociado a hemibloqueo
anterior izquierdo (HBAI), son los trastornos de conducción más comunes
de la cardiopatía chagásica, aunque de escaso valor pronóstico. El
bloqueo completo de rama izquierda (BCRI) y el hemibloqueo posterior
izquierdo (HBPI) son poco frecuentes, pero su presencia se asocia a un
pronóstico desfavorable.
Implante de marcapasos definitivo
Clase I
1.- Bloqueo de rama bilateral alternante documentado asintomático o con
síncope, presíncope o mareos recurrentes (Nivel de Evidencia C).
Clase IIa
1.- Intervalo HV mayor de 70 ms espontáneo o con bloqueo intra o
infrahisiano inducido por estimulación auricular o test farmacológico en
pacientes con síncope, presíncope o mareos recurrentes sin causa
predeterminada (Nivel de Evidencia C).
2.- Paciente asintomático con intervalo HV mayor de 100 ms espontáneo
(Nivel de Evidencia C).
Clase IIb
1.- Bloqueo de rama o bifascicular asociado o no a bloqueo AV de primer
grado sin documentación de bloqueo AV completo paroxístico (Nivel de
Evidencia C).
Recomendaciones para la indicación del modo de estimulación
Clase I
1.- VVI/R con fibrilación auricular permanente (Nivel de Evidencia B).
2.- DDD/R con disfunción sinusal (Nivel de Evidencia B).
3.- DDD/R con conducción VA retrógrada (Nivel de Evidencia B).
Clase II
1.- DDD/R con función sinusal normal sin conducción ventrículo atrial
(Nivel de Evidencia C).
2.- VVI/R sin conducción ventrículo atrial retrógrada (Nivel de
Evidencia C).
3.- VDD con aurícula estable y función sinusal normal (Nivel de
Evidencia C).
Clase III
1.- AAI/R (Nivel de Evidencia B).
2.- VVI/R con conducción ventrículo atrial retrógrada (Nivel de
Evidencia B).
3.- VDD con aurícula inestable o disfunción sinusal (Nivel de Evidencia
B).
ARRITMIAS VENTRICULARES
Prevención primaria
Recomendaciones para el implante de CD en la prevención primaria de
muerte súbita en pacientes con cardiopatía chagásica.
Clase I
Se indica implante de CDI en pacientes con disfunción ventricular o
disquinesias parietales asociadas a síncope no aclarado con TV/FV
inducible en el EEF, con independencia de la tolerancia hemodinámica
(Nivel de evidencia B).
Clase IIa
El implante de un CDI es razonable en pacientes con síncope de causa no
aclarada y con disfunción o disquinesia ventricular significativa (Nivel
de evidencia C).
Prevención secundaria
Los sobrevivientes de paro cardíaco por taquicardia ventricular o
fibrilación ventricular tienen u alto grado de recurrencia dentro del
año siguiente al evento. Durante muchos años se emplearon distintos
tipos de drogas antiarrítmicas con el empeño de prevenir un nuevo
episodio. La amiodarona demostró ser, probablemente la única,
especialmente útil en pacientes con fracción de eyección mayor al
35-40%. Sin embargo, la introducción del CDI es considerado hoy el más
importante avance en el tratamiento de la recurrencia de estos
episodios.
Recomendaciones para el implante de CD en la prevención secundaria de
muerte súbita en pacientes con cardiopatía chagásica.
Clase I
1.- Paro cardíaco por TV/FV de causa no reversible independientemente de
la fracción de eyección y expectativa de vida de al menos 1 año (Nivel
de evidencia A).
2.- Se indica implante de CDI en los pacientes que presentaron TV
espontánea con disfunción ventricular (o disquinesias parietales
asociadas) independientemente de la tolerancia hemodinámica (Nivel de
evidencia B).
3.- Sobrevivientes de paro cardíaco por TV/FV de causa no reversible con
fracción de eyección >35% y expectativa de vida de al menos 1 año (Nivel
de evidencia B).
Clase IIa
1.- Pacientes con TV sostenida espontánea de causa no reversible sin
compromiso hemodinámico y con función ventricular normal (fracción de
eyección >35%) refractaria a otras terapéuticas y expectativa de vida de
por lo menos 1 año.
2.- Pacientes con síncope de causa indeterminada con inducción de TV
sostenida hemodinámicamente inestable y expectativa de vida de por lo
menos un año.
Clase III
1.- TV incesante
Taquicardia Ventricular no sostenida (TVNS).Nivel de evidencia C
Intervienen 4 variables: función ventricular, síncope no aclarado, TVNS
e inducción en Estudio electrofisiológico (EEF)
Síncope no aclarado + TVNS + inducción TV/FV=CDI (Clase IIb)
Síncope no aclarado + TVNS + mala función ventricular <35% = CDI (Clase
lIb)
TVNS + mala función ventricular = EEF positivo CDI (Clase lIb)
negativo drogas antiarrítmicas (Clase IIb)
Las arritmias supraventriculares: rápidas no constituyen una
circunstancia especial en la enfermedad de Chagas. Tanto cuando se
presentan como un síndrome bradi-taquicárdico o como fibrilación
auricular, taquicardia auricular, taquicardia supraventricular en el
contexto de la miocardiopatía no difieren ni tienen ninguna
particularidad por tratarse de Chagas. Su tratamiento, ya sea
medicamentoso o invasivo es el mismo que el señalado en el consenso de
arritmias por el consejo de electrofisiología.
MIOCARDIOPATIA CHAGASICA DILATADA
EPIDEMIOLOGIA
Del total de pacientes infectados con T. Cruzi, entre un 20 a 30%
evolucionan hacia la cardiopatía y un 10% hacia la forma dilatada.
MIOCARDIOPATIA CHAGASICA DILATADA
Prevalencia Estudio Remida 5,9%
Características 1) cardiopatía dilatada, 2) predomina en hombres entre
4° y 6° década, 3) muerte entre 30-50 años, 4) complicaciones: arritmias
(taqui y bradiarritmias) insuficiencia cardíaca biventricular
(Prevalencia Estudio Hospital 5,47%), tromboembolismo.
CLINICA DE LA INSUFICIENCIA, CARDIACA EN LA ENFERMEDAD DE CHAGAS (Ver
Tabla I).
METODOLOGIA DE ESTUDIO
Los procedimientos diagnósticos en el paciente con miocardiopatía
chagásica crónica están dirigidos a: 1) El diagnóstico de certeza de
insuficiencia cardíaca, 2) Causas desencadenantes o agravantes, 3)
Estudios de alteración de la función ventricular, 4) Evaluación de
alteraciones funcionales, 5) Evaluación de la respuesta terapéutica, 6)
Criterios evolutivos y pronósticos. En este tópico en particular se
evaluará la metodología de estudio en pacientes chagásicos dilatados en
presencia de: A) Insuficiencia cardíaca descompensada, y B)
Insuficiencia cardíaca crónica.
A) Insuficiencia cardíaca descompensada.
Clase I
1. Examen semiológico completo.
2. Electrocardiograma convencional de 12 derivaciones.
3. Laboratorio de rutina completo.
4. Monitoreo continuo: Electrocardiográfico, oximetría de pulso, tensión
arterial no invasiva o invasiva y temperatura corporal.
5. Rx de Tórax.
6. Ecocardiograma Bidimensional y Doppler.
Clase II:
1. Evaluación de la función ventricular invasiva (Swan Ganz). Cuando no
hay respuesta al tratamiento convencional.
2. Registro electrocardiográfico continuo sistema Holter de 24 horas
Clase III:
1. Ergometría.
2. Perfusión miocárdica en reposo y esfuerzo
3. Cateterismo cardíaco: En pacientes con enfermedad terminal (Cáncer,
HIV, etc.) que impidan cirugía cardiovascular mayor.
B) Insuficiencia cardíaca crónica
Clase I:
2. Examen clínico.
3. Electrocardiograma convencional de 12 derivaciones.
4. Telerradiografía de tórax (frente y perfil).
5. Laboratorio de rutina completo.
6. Ecocardiograma bidimensional y Doppler.
7. Registro electrocardiográfico continuo sistema Holter de 24 h
8. Estudios invasivos: Cateterismo o estudio electrofisiológico (sólo,
serán clase I en caso de antecedentes de muerte súbita y/o arritmias
ventriculares graves).
Clase II:
1. Ergometría: En pacientes clase funcional I a III para evaluar
respuesta terapéutica.
2. Test de caminata de 6 minutos.
4. Perfusión miocárdica en reposo y esfuerzo
6. Ecocardiograma transesofágico.
7. Consumo de oxígeno.
8. Biopsia endomiocárdica: En pacientes en espera de trasplante
cardíaco.
Clase III:
1. Ergometría: En pacientes en clase funcional IV o arritmias
ventriculares severas en reposo.
2. Cateterismo cardíaco: En pacientes con enfermedad terminal asociada
(Cáncer, HIV) que impida cirugía cardiovascular mayor posterior.
3. Biopsia endomiocárdica: En pacientes que no se encuentran en plan de
trasplante.
C. Aneurisma ventricular de origen chagásico en presencia de
miocardiopatía dilatada
Clase I:
1. Iguales estudios que en A o B.
2. Estudio electrofisiológico: Previo a la aneurismectomía para el mapeo
de la arritmia ventricular.
Clase II:
1. Iguales estudios que en A o B.
Clase III:
1. Ergometría: En presencia de arritmia ventricular compleja o clase
funcional IV.
2. Coronario grafía: Si se decidió no realizar aneurismectomía.
TRATAMIENTO DE LA CARDIOPATIA CHAGASICA DILATADA CRONICA
El tratamiento de la insuficiencia cardíaca en la miocardiopatía
chagásica está dirigido a actuar sobre los mecanismos neuro-hormonales
que la perpetúan o agravan. Las terapéuticas se deben orientar a mejorar
los hábitos de vida, establecer una dieta adecuada y la administración
de medicamentos que cambian el curso natural de la enfermedad como las
drogas inhibidoras de la enzima conversora de la angiotensina, los
bloqueantes de los receptores de la angiotensina, los bloqueadores de la
aldosterona y los betabloqueantes. En casos apropiados, son útiles los
dispositivos electrofisiológicos (marcapasos, resincronizadores,
cardiodesfibriladores) y otros tratamientos invasivos. Tabla II.
La nueva Clasificación del ACC/AHA para la IC, permite diferenciar
estadíos de riesgo para desarrollar la enfermedad y estadíos de IC
propiamente dicha, y establecer su correspondiente tratamiento. Los
estadíos A y B de esta clasificación corresponden a pacientes
asintomáticos, en clase funcional (CF) I de la New York Heart
Association (NYHA), mientras que los estadíos C y D corresponde a los
pacientes con síndrome de IC, en CF II a IV de la NYHA. Esta
clasificación puede ser también aplicada a la enfermedad de Chagas
(Tabla 2).
Estadío A: pacientes con factores de riesgo para desarrollar la
enfermedad, pero sin daño miocárdico estructural, en quienes estaría
indicada la prevención primaria. En este estadío podemos incluir a los
pacientes seropositivos sin evidencias de cardiopatía y aquellos con
arritmias y trastornos de la conducción, pero sin afección miocárdica
evidente en el ecocardiograma.
Estadío B: pacientes que presentan daño miocárdico estructural, en
quienes se deben tomar medidas de prevención secundaria. El
ecocardiograma resulta de vital importancia para la valoración de esta
etapa. El remodelado ventricular, las alteraciones regionales de la
contracción, los aneurismas, la dilatación y la disfunción ventricular
asintomática, son componentes de la miocardiopatía chagásica en el
estadío B.
Estadío C: pacientes con daño cardíaco estructural que ya han
desarrollado síntomas y signos de IC. En este estadío se recomiendan las
medidas generales para IC, los tratamientos farmacológicos y
ocasionalmente dispositivos electrofisiológicos, tendientes a mejorar la
calidad de vida y disminuir la mortalidad.
Estadío D: pacientes en IC avanzada, con gran deterioro de la función
ventricular y de la capacidad funcional, refractarios al tratamiento
óptimo disponible, con frecuentes hospitalizaciones y que requieren de
estrategias de soporte especiales: inotrópicos endovenosos, asistencia
circulatoria mecánica, terapia de resincronización cardíaca, trasplante
cardíaco, alternativas quirúrgicas, terapia celular, etc.
Con el objetivo de sintetizar este consenso se enuncian solamente
aquellos puntos particulares para la cardiopatía chagásica.
MEDIDAS GENERALES
Las medidas generales, no farmacológicas, tienen tanta importancia como
la terapia medicamentosa, y de su cumplimiento dependerá en gran parte
el pronóstico de la enfermedad y la calidad de vida del paciente. Lograr
una adecuada adherencia al tratamiento es uno de los objetivos más
importantes, sobre todo teniendo en cuenta la baja condición
socioeconómica común a los enfermos de Chagas, la que dificulta el
acceso a los controles y las medidas terapéuticas.
Se debe promover la educación del paciente, el cuidado del peso, la
dieta hiposódica, la restricción hídrica en pacientes con síntomas
graves o con hiponatremia, la cesación del tabaquismo y la moderación o
abstinencia de alcohol y la actividad física regular en los enfermos
estables. Pueden resultar de suma utilidad, cuando están disponibles,
los programas de manejo de IC.
TRATAMIENTO FARMACOLOGICO
La miocardiopatía chagásica cuenta con escasas evidencias de nivel A
para su tratamiento. Por este motivo, las recomendaciones se basarán en
evidencias provenientes de estudios de nivel B o en la opinión de
expertos (nivel C).
- Inhibidores de la enzima convertidora de angiotensina (IECA)
• Deben recibir IECA los pacientes con FE < 40% asintomáticos o con IC
leve a grave (CF I-IV, estadios B, C y D) a menos que existan
contraindicaciones o no sean tolerados (Clase I. Nivel de evidencia B).
- Antagonistas del receptor de angiotensina II (ARAII)
Su uso en la IC es más controvertido. El Consenso de IC de la SAC
sugiere indicar ARAII en las siguientes situaciones:
• Pacientes con FE < 40%, asintomáticos o con IC leve a grave (CF I-IV,
estadios B, C y D) con intolerancia a los IECA (Clase I. Nivel de
evidencia B).
• Pacientes con FE < 40% e IC sintomática (estadios C y D) en
tratamiento con dosis óptima de IECA y BB, a menos que estén tratados
con AA (Clase lIb. Nivel de evidencia B).
- Beta bloqueantes (BB)
En la miocardiopatía chagásica la presencia de bradicardia y de
alteraciones del sistema nervioso autónomo, obligan a tener precauciones
con el empleo de los BB.
• Deben recibir BB los pacientes con FE < 40% asintomáticos o con IC
leve a grave (CF I-IV, estadios B, C y D), a menos que existan
contraindicaciones o no sean tolerados (Clase IIa. Nivel de evidencia
B).
• Se encuentran contraindicados en los pacientes con broncoespasmo,
bloqueo aurículoventricular de segundo o tercer grado, enfermedad del
nódulo sinusal y bradicardia sinusal sintomática (FC < 50 lat/min).
(Clase III Nivel de evidencia B).
- Antagonistas de la aldosterona (AA)
La espironolactona podría atenuar el proceso fibrótico, predominante en
la miocardiopatía chagásica.
• Deben recibir Espironolactona los pacientes con FE < 35% e IC avanzada
(CF III-IV, estadio D) a menos que existan contraindicaciones o no sean
tolerados (Clase I. Nivel de evidencia B).
• Podrían beneficiarse con los AA los pacientes con IC moderada (CF II,
estadio C) (Clase IIa. Nivel de evidencia C).
- Hidralazina y Dinitrato de isosorbide
Actualmente su indicación se restringe a:
• Pacientes FE < 40%, o con IC sintomática (CF II-IV, estadios C y D)
que no toleren la indicación de IECA ni ARA II (Clase IIa Nivel de
evidencia B).
- Digoxina
En el paciente chagásico, las alteraciones del automatismo y de la
conducción asociados a arritmias ventriculares malignas o potencialmente
malignas, restringen su uso. La digoxina puede agravar la disautonomía y
los trastornos del ritmo y de la conducción.
Se recomienda su uso en:
• Pacientes con fibrilación auricular (FA) con alta respuesta
ventricular (Clase I. Nivel de evidencia C).
• Pacientes con FA de moderada respuesta e IC moderada a grave (CF
III-IV, estadio D) (Clase IIa. Nivel de evidencia C).
• Pacientes con ritmo sinusal, FE < 40% e IC moderada a grave (CF
III-IV, estadio D), en tratamiento con dosis óptima de IECA o ARA II,
BB, AA (Clase lIb. Nivel de evidencia B).
• En la enfermedad de Chagas no debe ser utilizado en caso de FA de baja
respuesta, bradicardia sinusal, bloqueo trifascicular de rama, bloqueo
sinoauricular o bloqueo AV de 2° o 3° grado, al menos que el paciente
porte un marcapasos con correcto funcionamiento (Clase III, Nivel de
evidencia B).
- Diuréticos
• Deben indicarse diuréticos a los pacientes con IC y síntomas y signos
de retención hidrosalina (CF II a IV, estadio C y D) (Clase I. Nivel de
evidencia B).
- Anticoagulantes orales y antiagregantes plaquetarios
Son indicaciones de anticoagulación oral en la miocardiopatía chagásica:
• Fibrilación auricular (permanente, persistente o paroxística) (Clase
I. Nivel de evidencia A) (84).
• Antecedente de embolia sistémica (Clase I. Nivel de evidencia C)
(85,86).
• Evidencia por imágenes de trombo intracavitario (Clase I. Nivel de
evidencia C) (85,86).
• Aneurisma apical sin evidencia de trombo (Clase lIb. Nivel de
evidencia C).
• La aspirina y otros antiagregantes plaquetarios, no tienen indicación
sistemática en la miocardiopatía chagásica (Clase III. Nivel de
evidencia C).
- Amiodarona
El estudio GESICA incluyó 10% de pacientes chagásicos demostrando una
disminución en la mortalidad por progresión de insuficiencia cardíaca o
muerte súbita. Sin embargo la superioridad de los BB desplazó su
indicación.
• Sólo se justifica la indicación de Amiodarona como tratamiento de la
IC, en pacientes con contraindicación o intolerancia a los BB. (Clase
lIb. Nivel de evidencia B). La indicación habitual de la droga son las
arritmias.
- Tratamiento antiparasitario
La indicación de tratamiento etiológico tripanocida con Benznidazol o
Nifurtimox en el paciente con Enfermedad de Chagas crónica es motivo de
discusión. Las indicaciones consideradas son:
• Miocarditis chagásica aguda sobre cardiopatía chagásica crónica,
producto de una reinfección endógena, en pacientes trasplantados, con
síndrome de inmunodeficiencia adquirida (SIDA) o inmunodeprimido por
otra causa (Clase I. Nivel de evidencia C).
• Receptor chagásico en trasplante de órganos como profilaxis (Clase
IIa. Nivel de evidencia C).
• Es controvertida la indicación de tratamiento antiparasitario en el
paciente con IC debido a miocardiopatía chagásica crónica (Clase IIb.
Nivel de evidencia B).
- Resumiendo: todos los pacientes con IC debida a miocardiopatía
dilatada de origen chagásico en cualquiera de sus estadios (B, C, o D)
deberían recibir un IECA (o en su defecto un ARAII) y BB, siempre que
éstos sean bien tolerados y se descarten las contraindicaciones. En los
pacientes sintomáticos o con signos congestivos (estadios C y D) están
indicados las medidas generales y los agentes diuréticos. En aquellos
que se encuentren con IC en CF III-IV (estadio D) se recomienda, además,
un AA. Los que presenten FA, antecedentes embólicos o presencia de una
aneurisma apical con trombo deben ser anticoagulados. La digitalización
cuidadosa está indicada en la FA cuando existe alta respuesta
ventricular.
REHABILITACION CARDIOVASCULAR
La rehabilitación cardiovascular tiene como objetivo principal mejorar
la calidad de vida, la morbimortalidad, modificación del sedentarismo,
aumento de la capacidad funcional, combatir el stress, disminuir la
ansiedad, modificar los factores de riesgo y la reinserción laboral y
social de los pacientes. Criterios de inclusión pacientes portadores de
miocardiopatía chagásica en insuficiencia cardíaca clase I, II y III de
la NYHA. Se deben excluir pacientes con clase funcional IV de la NYHA,
arritmias complejas; antecedentes de adicciones a drogas; alcoholismo.
Es importante tener en cuenta los requerimientos de energía en la vida
diaria y en las actividades laborales para poder indicar correctamente
tareas acordes con su discapacidad, así como tener en cuenta la
sobrecarga que provocan ciertos actos fisiológicos como la actividad
sexual, el exceso de comidas, etc.
(Ver Algoritmo de Rehabilitación cardiovascular)
INSUFICIENCIA CARDIACA AVANZADA
De acuerdo al Consenso de Insuficiencia Cardíaca desarrollado por el
Consejo de Insuficiencia Cardíaca de la Sociedad Argentina de
Cardiología se define y trata como “insuficiencia cardíaca avanzada” al
cuadro clínico caracterizado por la persistencia de síntomas en clase
funcional III-IV de la New York Heart Association (NYHA), a pesar del
tratamiento médico completo y optimizado (diuréticos, BB, IECA/ARAII y
AA) en un paciente con deterioro grave de la función ventricular.
INSUFICIENCIA CARDIACA. TRATAMIENTO ELECTRICO
La estimulación biventricular es decir la resincronización, ha mostrado
buenos resultados en casos aislados cuando el paciente a tratar presenta
insuficiencia cardíaca refractaria a pesar del tratamiento farmacológico
óptimo, en clase funcional III/IV con bloqueo completo de rama izquierda
e importante incremento de la duración del QRS (?150 ms) y discinesia y
disincronía intra e interventricular. Todos los estudios en gran escala
fueron realizados en pacientes con miocardiopatía dilatada idiopática o
isquémica.
Aunque en el paciente chagásico el bloqueo de rama izquierda es raro y
existe un franco predominio de bloqueo completo de rama derecha con
hemibloqueo anterior se han publicado casos con claro beneficio mediante
la estimulación biventricular.
Tanto como el bloqueo de rama izquierda el de rama derecha se identificó
últimamente como un predictor independiente de mortalidad en pacientes
con insuficiencia cardíaca congestiva.
Recomendaciones para el implante de Resincronizador Cardíaco
TERAPIA DE RESINCRONIZACION CARDIACA
Los pacientes con deterioro de la función ventricular izquierda e IC
presentan, con una frecuencia variable, trastornos eléctricos de
conducción y disincronía en la contracción. Esta disincronía puede
presentarse entre ambos ventrículos (interventricular), entre los
distintos segmentos del ventrículo izquierdo (intraventricular) o ser
aurículoventricular. Su resultado será el empeoramiento de la función
ventricular con aumento de los volúmenes ventriculares y reflujo mitral.
Los ensayos iniciales, de tipo fisiopatológico, fueron seguidos por
estudios que incluyeron puntos finales de valor clínico
(mortalidad/reinternaciones).
Como resultado, se puede concluir que la TRC disminuye la mortalidad
promedio en un 22% y las reinternaciones por falla cardíaca en un 37% en
pacientes con deterioro grave de la función ventricular y CF avanzada.
La reducción de la mortalidad es aplicable tanto a la muerte por
progresión de la falla cardíaca como a la muerte súbita. En pacientes
con deterioro de la función ventricular, ritmo sinusal y QRS ancho pero
con escaso compromiso de la capacidad funcional, dos estudios recientes,
MADITCRT y REVERSE, demostraron que el dispositivo mejora la evolución
clínica sin impacto sobre la mortalidad.
Se estima que entre los pacientes con indicación de TRC un 30% resultan
no respondedores, es decir, sin mejoría clínica. Esto puede deberse a
una selección incorrecta del paciente (ausencia de disincronía
mecánica), necrosis en el sitio de implante del electrodo izquierdo,
imposibilidad de acceder al sitio de mayor disincronía, ausencia de
ritmo de marcapasos durante lapsos prolongados, etc. En pequeños
estudios, algunos parámetros ecocardiográficos de disincronía han
demostrado utilidad para identificar quiénes se beneficiarán con el
implante, pero esto aún no se ha podido confirmar en estudios
multicéntricos de mayores dimensiones. El uso generalizado de la
ecocardiografía no está indicado para selección de candidatos, aunque es
de utilidad en algunos pacientes que generan dudas.
Indicaciones de terapia de resincronización cardíaca
Clase I
- Pacientes con IC crónica en CF III-IV (al menos 6 meses de evolución)
bajo tratamiento médico máximo, con Fey < 35%, ritmo sinusal y ancho del
QRS d=?150 mseg (Nivel de evidencia A).
- Pacientes que tienen indicación de marcapasos o que ya lo tienen
implantado y necesitan un recambio (probable upgrade), que presentan IC
crónica en CF III-IV (al menos 6 meses de evolución) bajo tratamiento
médico máximo posible, con Fey < 35% (Nivel de evidencia B).
- Pacientes con indicación de TRC en los que además debería indicarse un
CDI (75-76):
- En “prevención secundaria”: pacientes con indicación de CDI
(taquicardia ventricular sostenida o muerte súbita) (Nivel de evidencia
A).
- En “prevención primaria” debería considerarse la indicación de TRC
asociada con CDI en pacientes jóvenes, que no tengan comorbilidades
graves y con una expectativa de vida mayor de 2 años, en especial con
antecedente de episodios de taquicardia ventricular (Nivel de evidencia
C).
Clase IIa
- Pacientes con IC crónica en CF III-IV (al menos 6 meses de evolución)
bajo tratamiento médico máximo, con Fey < 35%, ritmo sinusal y ancho de
QRS entre 120-150 mseg. Se sugiere realizar evaluación de parámetros de
disincronía mecánica (Nivel de evidencia B).
- Pacientes con IC crónica en CF I-II, con tratamiento médico máximo,
con Fey < 30%, ritmo sinusal y ancho del QRS =?150 mseg (Nivel de
evidencia B).
Clase Ilb
- Pacientes con IC crónica en CF III-IV (al menos 6 meses de evolución)
bajo tratamiento médico máximo, con Fey < 35%, con fibrilación auricular
y ancho de QRS =?150 mseg. Es necesario generar un bloqueo A-V
farmacológico o por ablación del nódulo A-V para asegurarse de que la
mayoría de los latidos van a ser conducidos por el resincronizador
(Nivel de evidencia B).
- Pacientes que tienen indicación de marcapasos o que ya lo tienen
implantado y necesitan un recambio (probable upgrade) con Fey < 35%,
pero sin evidencias clínicas de IC. Debería analizarse el tiempo de
marcapaseo que requiere el paciente y, en caso de que sea elevado, puede
plantearse la posibilidad de TRC (Nivel de evidencia C).
TRASPLANTE CARDIACO
La miocardiopatía chagásica dejó de ser una contraindicación para TC ya
que, aunque ofrece dificultades, puede realizarse exitosamente
(Caravalho VB 1996, Bocchi EA 2001).
Recomendaciones para trasplante cardíaco en pacientes con miocardiopatía
chagásica avanzada:
Clase I
• Pacientes en shock cardiogénico, dependientes de drogas parenterales,
ARM y/o ACM (Nivel de evidencia C).
• Pacientes con IC avanzada y marcadores de elevada mortalidad (>30%)
dentro del año, a pesar del tratamiento médico óptimo y ajustado (Nivel
de evidencia C).
• Pacientes en IC avanzada con consumo de O2 máximo < 10 ml/Kg/min
(Nivel de evidencia C).
• Pacientes con IC y arritmia ventricular grave sintomática refractaria
al tratamiento antiarrítmico y a CDI (Nivel de evidencia C).
Clase IIb
• Pacientes en IC con consumo de O2 máximo entre 11 y 14 ml/Kg/min, se
propone realizar un score de riesgo para ayudar a estratificar el
pronóstico (Nivel de evidencia C).
• Pacientes con indicación de TC y contraindicación relativa (Nivel de
evidencia C).
Clase III
• Pacientes con IC bajo tratamiento médico incompleto (Nivel de
evidencia C).
• Pacientes con contraindicaciones absolutas para TC (Nivel de evidencia
C).
ALTERNATIVAS QUIRURGICAS
La demanda de donantes para TC no logra satisfacer la necesidad de
órganos por lo cual las cirugías alternativas tienen especial
relevancia, no sólo por no requerir oferta de donantes, sino por los
resultados comparables al trasplante.
Es alentador el panorama que ofrece la terapia celular con células
madre, procedimientos que se encuentran en desarrollo clínico y sobre el
que se están acumulando experiencias prometedoras tanto en
miocardiopatía isquémica como no isquémica, incluida la chagásica.
|
Tabla I. |
Clínica de la
miocardiopatía crónica chagásica |
|
APARATOS Y
SISTEMAS |
SINTOMATOLOGIA Y
SIGNOS |
|
CARDIOVASCULAR |
Palpitaciones,
angor atípico, síncope, edemas bimaleolares, reflujo
hepatoyugular, hipotensión. |
|
RESPIRATORIO |
Disnea de
esfuerzo, ortopnea, disnea paroxística nocturna, edema agudo de
pulmón y tos cardial. |
|
GASTROINTESTINAL |
Anorexia,
nauseas, hepatomegalia congestiva con dolor en hipocondrio
derecho y epigastrio, pesadez postprandial, estreñimiento. |
|
URINARIO |
Oliguria con
nicturia. |
|
CEREBRALES |
Confusión,
cefaleas, alteración de la concentración, pérdida de memoria. |
Tabla II: Estadios de desarrollo de la insuficiencia cardíaca y terapia
recomendada en la miocardiopatía chagásica
(Adaptado ACC/AHA 2005 Guideline update for the diagnosis and management
of chronic heart failure in the adult)
IECA: inhibidores de la enzima convertidora de angiotensina II; ARA II:
antagonistas de los receptores de angiotensina II; AA: antagonistas de
aldosterona.
ALGORITMO DE REHABILITACION CARDIOVASCULAR (RHCV) EN PATOLOGIA CHAGASICA
9. ANEXO III. Eventos adversos más frecuentes o graves con el uso de
benznidazol o nifurtimox.
Recomendaciones sobre su manejo (adaptado del Proyecto BENEFIT).
10. INSTITUCIONES COORDINADORAS
Instituto Nacional de Parasitología “Dr. Mario Fatala Chabén”. Centro
Nacional de Diagnóstico e Investigación de Endemoepidemias (CeNDIE)
Dr. Sergio Sosa Estani
Dra. Adelina Riarte
Dra. Ana María de Rissio
Dra. Nilda Prado
Bioq. Karenina ScolIo
Bioq. Mónica Inés Esteva
Dr. Gonzalo Tomás
Dra. Elsa Leonor Segura
Dirección de Enfermedades Transmisibles por Vectores
Dr. Héctor Coto
Bioq. Cynthia Spillmann
Dr. Mario Zaidenberg
Dr. Héctor Freilij
Dr. Lisandro Colantonio
Dra. Susana G. Pérez
Secretarios
Dr. Lisandro Colantonio
Dr. Gonzalo Tomás
Dra. Susana G. Pérez
11. ORGANIZACIONES PARTICIPANTES
Ministerio de Salud de la Nación
Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT)
Dra. Rosa María Papale
Farm. Claudia Santucci
Centro Nacional de Genética Médica (ANLIS)
Dr. Pablo Barbero, responsable de la Línea Salud Fetal
Dirección de Epidemiología
Dr. Horacio Echenique
Dra. Mabel Moral
Lic. Goyo Giovacchini
Lic. Julián Antman
Dirección Nacional de Maternidad e Infancia
Dra. Ana Speranza
Dra. Susana Devoto
Plan Nacional de Sangre
Dra. Mabel Maschio
Programa Médicos Comunitarios, Equipos de Salud del Primer Nivel de
Atención
Dr. Gustavo Orsi
Programa REMEDIAR + Redes
Dr. Carlos Cairo
Dra. Analía Gil
Representantes de Programas Provinciales de Chagas
Provincia de Catamarca
Dr. Alejandro Santillan Iturres
Provincia del Chaco
Dr. Sebastián Genero
Provincia de San Juan
Dr. Rubén Carrizo Páez
Provincia de Santa Fe
Dr. Marcelo Nepote
Dra. María Ercole
Organización Panamericana de la Salud - Organización Mundial de la Salud
Dr. Roberto Salvatella Agrelo, asesor regional sobre Enfermedad de
Chagas
Sociedades Científicas
Asociación Argentina de Hemoterapia e Inmunohematología
Dr. Oscar Walter Torres
Dr. Alejandro Oscar Chiera
Federación Argentina de Medicina General
Dr. Emanuel Adrián Cardozo
Dr. Tomás Baliña
Dr. Horacio Daniel Boggiano
Sociedad Argentina de Cardiología, Consejo de Enfermedad de Chagas “Dr.
Salvador Mazza”
Dr. Ricardo Pesce, Director, MTSAC
Dr. Sergio Auger, Secretario Científico, MTSAC
Dr. Marcelo Benassi, Secretario Técnico, MTSAC
Dr. Acuña Luciano, Vocal Titular
Dr. Gilli Mónica, Vocal Titular
Dr. Albarez Regina, Vocal Titular
Dr. Tomasella Marcos, Vocal Titular
Dr. Valero Elina, Vocal Titular, MTSAC
Dr. Avayú Daniel, Vocal Suplente
Dr. Niero Felipe, Vocal Suplente
Dr. Palacios, Vocal Suplente
Dr. Alberto Lipschick, Vocal Suplente
Dr. Oscar Caravello, Vocal Suplente
Dr. Luisa Gimenez, Comité Asesor
Dr. Jorge Mitelman, Comité Asesor
Dr. Jorge Gonzalez Zuelgaray, Comité Asesor
Dr. Horacio Romero Villanueva, Comité Asesor
Federación Argentina de Cardiología
Dr. Oscar Mordini, Situación epidemiológica en Córdoba
Dr. Juan Beloscar Situación epidemiológica en Rosario
Sociedad Argentina de Coloproctología
Dr. Mario C. Salomón, Presidente
Dr. Marcelo J. Colina
Dr. Hugo R. Amarillo
Sociedad Argentina de Infectología, Comisión de Emergentes y
Enfermedades Endémicas
Dr. Héctor Laplumé, Coordinador, Coordinador
Dra. Susana Cristina Lloveras, Miembro
Dra. Ana María Molina, Miembro
Dra. Paola Salvador, Miembro
Sociedad Argentina de Pediatría
Dr. Jaime Altcheh
Sociedad Argentina de Trasplantes
Dra. Claudia Salgueira, Directora de la Comisión de Infecciones en
Trasplante de órgano sólido
Instituciones
Depto. de Microbiología, Parasitología e Inmunología. Facultad de
Medicina. Universidad de Buenos Aires (UBA)
Dra. Biol. María Elisa Solana
Servicio de parasitología-Chagas, Hospital de Niños, Buenos Aires,
Centro de referencia para la enfermedad de Chagas (resol. 1514/2001, M.
Salud, GCBA)
Dr. Guillermo Moscatelli
Dr. Facundo Garcia Bournissen
Expertos invitados
Dr. Tomás Agustín Orduna, Médico Infectólogo, Jefe de Servicio,
Patologías Regionales y Medicina Tropical (CEMPRA-MT), Hospital de
Infecciosas F J Muñiz - Buenos Aires.
Dr. Javier Altclas, Médico Infectólogo, Jefe de Infectología, Sanatorio
Trinidad, Mitre y Anchorena.
Dr. Julio Lázzari, TDR/WHO
Dra. Ana Emilia del Pozo, Consultora del Centro Regional de Hemoterapia
y del Banco Público de Referencia Nacional de Sangre de Cordón Umbilical
Hospital de Pediatría “Profesor Dr. JP Garrahan”, Buenos Aires,
Argentina.