Ministerio de Salud
SALUD PUBLICA -
RECOMENDACIONES PARA LA IMPLEMENTACION DE TEST RAPIDOS EN EL DIAGNOSTICO
DE VIH Y OTRAS ITS
Resolución (MS) 1340/13. Del 27/8/2013.
B.O.: 30/8/2013. Recomendaciones para la implementación de Test rápidos
en el diagnóstico de VIH y otras ITS.
Bs. As., 27/8/2013
VISTO, el expediente Nº 1-2002-8692/13-2 del Registro del MINISTERIO DE
SALUD, y
CONSIDERANDO:
Que nuestro país ha sancionado la Ley Nº 26.529 de los derechos del
paciente, que tiende a garantizar entre otros derechos el derecho a una
asistencia integral y digna de la salud.
Que a través del artículo 75 inc. 22 de la CONSTITUCION NACIONAL, la
REPUBLICA ARGENTINA ha incorporado dentro de su plexo constitucional el
derecho a la salud a través de disposiciones tales como los artículos 25
de la Declaración Universal de Derechos Humanos, 16 de la Declaración
Americana de Derechos y Deberes del Hombre, 12 del Pacto Internacional
de Derechos Económicos, Sociales y Culturales, 23 incisos 3 y 4, 24, 25,
26, 27, 32 y 39 de la Convención sobre los Derechos del Niño, 10 h),
11.1 e) y f), 11.2, 12, 14 b) y c), y 16 e) de la Convención
Internacional para la Eliminación de Todas las Formas de Discriminación
contra la Mujer, y 5 e.iv) de la Convención Internacional para la
Eliminación de Todas las Formas de Discriminación Racial.
Que a su vez la REPUBLICA ARGENTINA ha depositado el documentado de
ratificación del Protocolo de San Salvador el 23 de octubre de 2003 y
con ello se ha obligado a garantizar a toda persona el disfrute del más
alto nivel de bienestar físico, mental y social.
Que las últimas estimaciones informan que en nuestro país viven 130.000
personas con VIH de las cuales el 40% desconocen su serología. Las
cifras de diagnósticos tardíos, obtenidas de las notificaciones,
reportan un 25,3 de diagnósticos tardíos en el año 2010, correspondiendo
un 29,5% a varones y un 17,3% a mujeres.
Que en función de ello nace la necesidad de crear alternativas para
facilitar el acceso al diagnóstico del VIH y otras ITS atendiendo al
principio constitucional del derecho a la salud;
Que ONUSIDA/OMS propone como estrategia 2011-2015 “Llegar a 0”. La misma
incluye entre sus objetivos reducir a la mitad la transmisión sexual y
acabar con la transmisión vertical del VIH.
Que la estrategia “Tratamiento 2.0” promovida por OPS/OMS incluye como
uno de sus pilares fundamentales el acceso oportuno al diagnóstico
debido al impacto, en términos individuales y comunitarios, en la
disminución de la morbimortalidad y la transmisión del VIH.
Que las recomendaciones internacionales establecen que la información
sobre la tasa de infección por el VIH en pacientes con tuberculosis es
esencial para responder al compromiso de prestar atención y apoyo
integral a la infección por el VIH y al SIDA, incluido el tratamiento
antirretroviral (ARV), en los pacientes con tuberculosis y seropositivos
para el VIH y por ello que la prueba de detección del VIH que es el
punto de acceso al tratamiento ARV.
Que el acceso al diagnóstico oportuno es un factor determinante para la
mejor respuesta al tratamiento de la infección por VIH, resultando en
una mejoría en la sobrevida del paciente; y que el tratamiento
antirretroviral con el objetivo de lograr carga viral indetectable,
disminuye la transmisión del virus.
Que es necesario crear alternativas para la ampliación del acceso al
diagnóstico de la infección por VIH y otras ITS en concordancia con los
principios de universalidad, equidad e integridad en el acceso a la
salud integral de las personas.
Que el conocimiento del estado serológico de las personas infectadas por
el VIH y otras ITS es fundamental para el cuidado de su salud y para la
prevención de nuevas infecciones.
Que la implementación del test rápido colabora en el proceso de
descentralización necesario para brindar una mejor respuesta a la
epidemia de VIH/SIDA, ya que no requiere de tecnología pesada o de alta
complejidad y por ello puede ser realizado en espacios del primer nivel
de atención e incluso en espacios comunitarios.
Que la utilización de test rápidos para VIH y otras ITS es una
oportunidad para mejorar el acceso, con gran rendimiento en cuanto a su
costo/efectividad y menores oportunidades perdidas.
Que la expansión del acceso a las pruebas diagnósticas mejora el acceso
universal a la prevención y atención del VIH y otras ITS.
Que la estrategia 2.0, promovida por OPS/OMS, plantea el acceso oportuno
al diagnóstico y tiene impacto en términos individuales y comunitarios
por disminuir la morbimortalidad y la transmisión del VIH.
Que la utilización de test rápidos cuenta con una amplia experiencia en
los hospitales públicos del país, donde están siendo utilizados en
parturientas sin controles prenatales, en caso de accidentes
ocupacionales y en situaciones de violencia sexual, entre otros.
Que la importancia del diagnostico oportuno de los individuos con la
finalidad de comenzar tempranamente el seguimiento y/o tratamiento que
posibilite una mejor calidad de vida;
Que el conocimiento del diagnóstico de VIH y otras ITS por parte de la
persona infectada, es fundamental para su mejor protección y adopción de
prácticas de cuidado, y para el control de la infección y la
diseminación del virus;
Que la SUBSECRETARIA DE PREVENCION Y CONTROL DE RIESGOS, la SECRETARIA
DE PROMOCION Y PROGRAMAS SANITARIOS avalan la aprobación de los
algoritmos para la realización del diagnóstico de VIH.
Que la DIRECCION GENERAL DE ASUNTOS JURIDICOS han tomado la intervención
de su competencia;
Que la presente se dicta de acuerdo a las facultades conferidas por el
Art. 23 Ter. Inc. 12 y 37 de la Ley de Ministerios T.O. Dto. 438/92 y
sus modificatorias.
Por ello,
EL MINISTRO DE SALUD
RESUELVE:
Artículo 1° — Apruébanse las RECOMENDACIONES PARA LA IMPLEMENTACION DE
TEST RAPIDOS EN EL DIAGNOSTICO DE VIH Y OTRAS ITS, de acuerdo al ANEXO I
que forma parte integrante de la presente resolución.
Art. 2° — Promuévase el uso del test rápido para el diagnóstico de la
infección de VIH y otras ITS conforme lo dispuesto en el ANEXO I de esta
resolución y según los algoritmos vigentes.
Art. 3° — Establécese que todos los reactivos utilizados para el
diagnóstico de la infección de VIH deben ser oportunamente aprobados por
la ADMINISTRACION NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGIA
MEDICA (ANMAT), dependiente de este Ministerio.
Art. 4° — Regístrese, comuníquese, publíquese, dése a la Dirección
Nacional de Registro Oficial. Cumplido, archívese.
ANEXO I
RECOMENDACIONES PARA LA IMPLEMENTACION DE
TEST RAPIDOS EN EL DIAGNOSTICO DE VIH Y OTRAS ITS
En los últimos años, los tests rápidos (TR) han ganado importancia en el
diagnóstico de la infección por VIH y otras ITS. En el caso de los TR
para VIH, su sensibilidad y especificidad es comparable con las pruebas
convencionales basadas en EIE y western blot. Estos ensayos están
basados en técnicas de inmunodot, aglutinación, inmunocromatografía.
Dichos test pueden ser utilizados en sangre entera, suero o plasma,
mostrando igual sensibilidad y especificidad en cualquiera de los tres
tipos de muestras. La mayoría de estos TR pueden ser realizados dentro
de los 30 minutos.
Sobre el proceso diagnóstico
- Se deben utilizar tests rápidos validados por la Administración
Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT).
- Las instituciones que utilicen test rápidos deberán desarrollar los
procesos de capacitación a los equipos de salud, necesarios y
pertinentes para la correcta implementación de la técnica rápida a ser
utilizada, conforme las recomendaciones, que oportunamente emita el
Ministerio de Salud de la Nación a través de la Dirección de Sida, ETS y
Hepatitis Virales.
- Los equipos de salud que utilicen test rápidos deberán desarrollar los
controles de calidad del proceso diagnóstico conforme las
recomendaciones del Ministerio de Salud de la Nación a través de la
Dirección de Sida, ETS y Hepatitis Virales, debiendo estar bajo la
supervisión de un profesional bioquímico todo el proceso de
capacitación, monitoreo y control de calidad.
- Las muestras deberán ser recolectadas de acuerdo con las instrucciones
del fabricante del Kit diagnóstico.
- La persona que se realiza el test deberá recibir asesoramiento pre y
post test conforme las recomendaciones del Ministerio de Salud de la
Nación a través de la Dirección de Sida, ETS y Hepatitis Virales,
debiendo firmar el correspondiente consentimiento informado.
- El test rápido deberá realizarse en el marco y de manera integrada al
circuito diagnóstico y asistencial local de modo tal de garantizar, en
caso de ser necesario, la solicitud de turnos, extracción de sangre,
traslado de la muestra y la derivación a médico tratante para realizar
la confirmación diagnóstica de acuerdo al algoritmo vigente al momento.
Es necesario tener previamente armado los sistemas de derivación
pertinentes.
Sobre la realización del Test Rápido
El tamizaje debe ser realizado con tests rápidos capaces de detectar
anticuerpos anti-HIV 1, incluyendo el grupo O y anticuerpos anti-HIV 2.
ALGORITMO 1. TAMIZAJE CON UNICO TEST RAPIDO
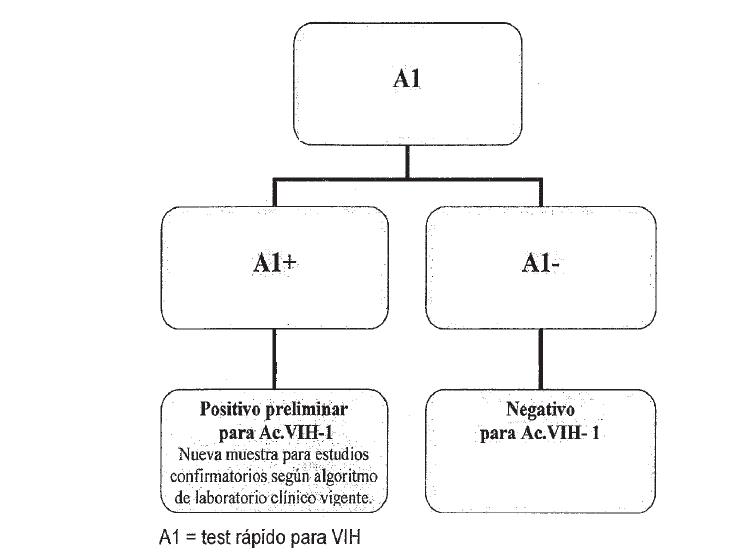
La muestra con resultado NEGATIVO en TR será definida como “MUESTRA
NEGATIVA PARA VIH”.
Se emitirá un informe con el resultado que incluya la siguiente
información: “En caso de identificar alguna situación de riesgo durante
al menos los 30 días anteriores al momento de realización de la prueba,
o persistencia de sospecha de infección por VIH, un nuevo test deberá
ser realizado después de pasados 30 días de la fecha de realización del
tests”.
La muestra con resultado POSITIVO será definida como “MUESTRA POSITIVA
PRELIMINAR PARA VIH” y se procederá a la recolección de una nueva
muestra con punción venosa para la realización de la confirmación
diagnóstica de acuerdo al algoritmo vigente”.
Se emitirá un informe con el resultado, “MUESTRA POSITIVA PRELIMINAR
PARA VIH “, destacando su carácter preliminar e indicando la realización
de nuevos estudios.
En el caso de que el resultado sea inválido, es necesario repetir el
test con el mismo Kit diagnóstico, si fuera posible con un lote distinto
al utilizado inicialmente. De persistir el resultado invalido se deberá
recolectar una nueva muestra con punción venosa y someterla a los
procedimientos de tamizaje convencionales. En este caso no se emite
informe con los resultados.
ALGORITMO 2. TAMIZAJE CON DOS TESTS RAPIDOS COMBINADOS EN SERIE
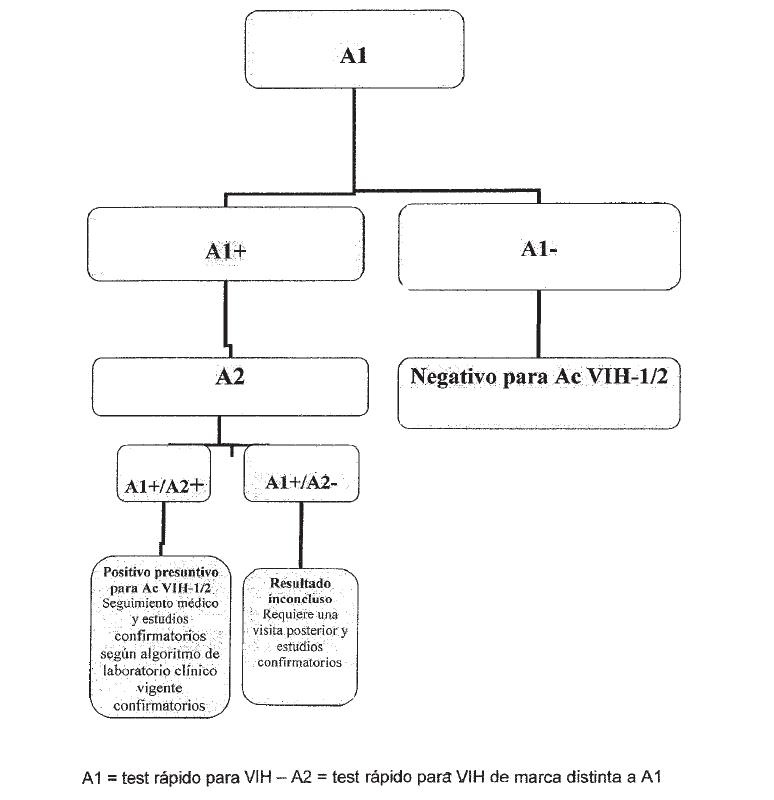
La muestra con resultado NEGATIVO en Test Rápido será definida como
“MUESTRA NEGATIVA PARA VIH”
El informe de resultado deberá incluir, además del resultado, la
siguiente información “En caso de identificar alguna situación de riesgo
durante al menos los 30 días anteriores al momento de realización de la
prueba, o persistencia de sospecha de infección por VIH, un nuevo test
deberá ser realizado después de pasados 30 días de la fecha de
realización del tests”.
La muestra con resultado POSITIVO en el Test Rápido 1 deberá ser
sometida al Test Rápido 2. Las muestras con resultados POSITIVO para 1 y
2 tendrá un resultado definido como “MUESTRA POSITIVA PRESUNTIVA PARA
VIH” y se procederá a la recolección de una nueva muestra con punción
venosa para la confirmación del diagnóstico conjuntamente con la
derivación al médico tratante.
Se emitirá un informe con el resultado que informando “MUESTRA POSITIVA
PRESUNTIVA PARA VIH”, la necesidad de confirmación del resultado.
Paralelamente se debe realizar la derivación al médico tratante.
Las muestras con resultados discordantes entre TR1 y TR2 no tendrán
resultado definido. En ese caso será necesaria la recolección de una
nueva muestra con punción venosa y sometida a los procedimientos
diagnósticos confirmatorios. En este caso no se emite informe con los
resultados.
En el caso de que el resultado de TR1 y/o TR2 sea inválido, es necesario
repetir el test con el mismo Kit diagnóstico, si fuera posible con un
lote distinto al utilizado inicialmente. De persistir el resultado
invalido se deberá recolectar una nueva muestra con punción venosa y
someterla a los procedimientos de tamizaje convencionales. En este caso
no se emite informe con los resultados.
Sobre el informe del resultado
En el informe de resultados realizado por un test rápido deberá constar:
1. Lugar y fecha de la realización del estudio
2. La interpretación final del resultado que podrá ser: “MUESTRA
POSITIVA PRELIMINAR PARA VIH” o “MUESTRA NEGATIVA PARA VIH”, “MUESTRA
POSITIVA PRESUNTIVA PARA VIH” o “MUESTRA NEGATIVA PARA VIH”.
3. El informe deberá estar en consonancia con las normativas vigentes al
respecto.