|
Administración Nacional de Medicamentos, Alimentos y Tecnología Médica PRODUCTOS DOMISANITARIOS - RESOLUCION MERCOSUR GMC N° 50/2006 - INCORPORACION Disposición (ANMAT) 3366/07. Del 12/7/2007. B.O.: 25/7/2007. Incorpórase al ordenamiento jurídico nacional la Resolución Mercosur GMC Nº 50/2006 "Reglamento Técnico Mercosur para Productos de Acción Antimicrobiana". Derógase el Artículo 1º de la Disposición Nº 6727/2003. Bs. As, 12/7/2007 VISTO el Tratado de Asunción del 26 de marzo de 1991, aprobado por Ley N° 23.981 y el Protocolo de Ouro Preto del 17 de diciembre de 1994, aprobado por Ley N° 24.560, la Resolución MERCOSUR GMC N° 50/06 y el Expediente N° 2002-8914-06-2 del Registro de esta Administración Nacional de Medicamentos, Alimentos y Tecnología Médica; y CONSIDERANDO: Que el proceso de integración del Mercosur es de la mayor importancia estratégica para la REPUBLICA ARGENTINA. Que, conforme a los artículos 2, 9, 15, 20, 38, 40 y 42 del Protocolo de Ouro Preto, las normas Mercosur aprobadas por el Consejo del Mercado Común, el Grupo Mercado Común y la Comisión de Comercio del Mercosur, son obligatorias y deben ser incorporadas, cuando ello sea necesario, al ordenamiento jurídico nacional de los Estados Partes mediante los procedimientos previstos en su legislación. Que conforme a los artículos 3, 14 y 15 de la Decisión 20/02 del Consejo del Mercado Común, las normas Mercosur que no requieran ser incorporadas por vía de aprobación legislativa podrán ser incorporadas por vía administrativa por medio de actos del Poder Ejecutivo. Que el artículo 7 de la citada Decisión establece que las normas Mercosur deberán ser incorporadas a los ordenamientos jurídicos de los Estados Partes en su texto integral. Que se ha dictado la Resolución MERCOSUR GMC N° 50/06 "REGLAMENTO TECNICO MERCOSUR PARA PRODUCTOS CON ACCION ANTIMICROBIANA (DEROGACION DE LA RES. GMC N° 28/02)". Que la Resolución MERCOSUR GMC N° 28/02 "REGLAMENTO TECNICO MERCOSUR PARA PRODUCTOS CON ACCION ANTIMICROBIANA" fue incorporada al ordenamiento jurídico nacional como Anexo XI de la Disposición ANMAT N° 7292/98, según lo dispuesto por el Artículo 1° de la Disposición ANMAT N° 6727/03. Que en consecuencia corresponde incorporar la Resolución MERCOSUR N° 50/06 como Anexo XI de la Disposición ANMAT N° 7292/98 y derogar el Artículo 1° de la Disposición ANMAT N° 6727/03. Que la DIRECCION DE ASUNTOS JURIDICOS ha tomado la intervención que le compete. Que la presente se dicta en ejercicio de las atribuciones conferidas por los Decretos 1490/92 y 197/02. Por ello, EL INTERVENTOR DE LA ADMINISTRACION NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGIA MEDICA DISPONE: Artículo 1° — Incorpórase al ordenamiento jurídico nacional, como Anexo XI de la Disposición ANMAT N° 7292/98, la Resolución MERCOSUR GMC N° 50/06 REGLAMENTO TECNICO MERCOSUR "PARA PRODUCTOS DE ACCION ANTIMICROBIANA", que se adjunta como anexo y forma parte integrante de la presente disposición. Art. 2° — Derógase el Artículo 1° de la Disposición ANMAT N° 6727/03. Art. 3° — En los términos del Protocolo de Ouro Preto, la norma que se incorpora por la presente Disposición, entrará en vigor simultáneamente en los Estados Partes, 30 días después de la fecha de la comunicación efectuada por la Secretaría del Mercosur informando que todos los Estados han incorporado la norma a sus respectivos ordenamientos jurídicos internos. La entrada en vigor simultánea de la Resolución MERCOSUR GMC N° 50/06 REGLAMENTO TECNICO MERCOSUR "PARA PRODUCTOS DE ACCION ANTIMICROBIANA" será comunicada a través de un aviso en el Boletín Oficial de la Nación (cfr. Artículo 40 inciso III del Protocolo de Ouro Preto). Art. 4° — De forma. MERCOSUR/GMC/RES. N° 50/06 REGLAMENTO TECNICO MERCOSUR PARA PRODUCTOS CON ACCION ANTIMICROBIANA (DEROGACION DE LA RES. GMC N° 28/02) VISTO: El Tratado de Asunción, el Protocolo de Ouro Preto, las Decisiones N° 20/02 y 08/03 del Consejo del Mercado Común y las Resoluciones N° 25/96, 27/96, 38/98, 35/99, 28/02 y 56/02 del Grupo Mercado Común. CONSIDERANDO: Que es necesario reglamentar las condiciones para el registro de productos domisanitarios con acción antimicrobiana. Que es necesario definir, clasificar y establecer criterios técnicos para los productos domisanitarios con acción antimicrobiana. EL GRUPO MERCADO COMUN RESUELVE: Art. 1 - Aprobar el "Reglamento Técnico MERCOSUR para Productos con Acción Antimicrobiana", que figura en el Anexo y forma parte de la presente Resolución. Art. 2 - Los Organismos Nacionales competentes para la implementación de la Resolución son:
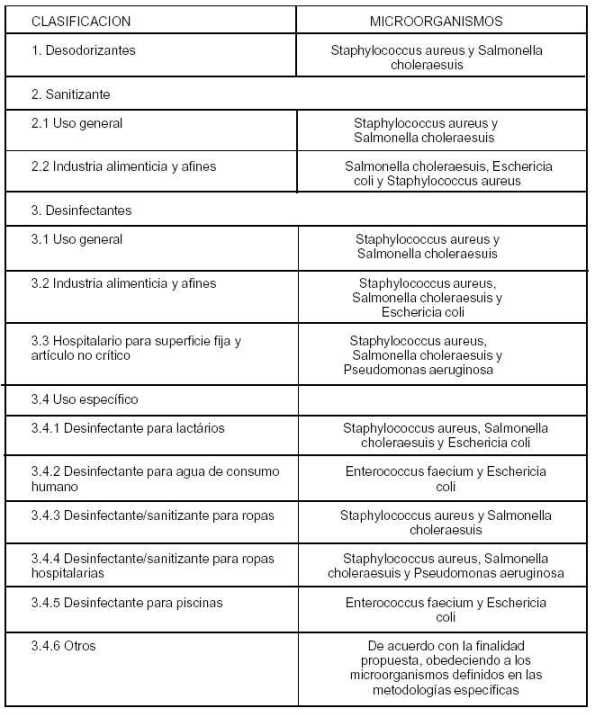
Art. 3 - La presente Resolución se aplicará en el territorio de los Estados Partes, al comercio entre ellos y a las importaciones extrazona. Art. 4 - Derogar la Resolución GMC N° 28/02. Art. 5 - Los Estados Partes deberán incorporar la presente Resolución a sus ordenamientos jurídicos nacionales antes del 23/V/2007. LXV GMC - Brasilia, 24/XI/06 ANEXO REGLAMENTO TECNICO MERCOSUR PARA PRODUCTOS CON ACCION ANTIMICROBIANA Los microorganismos son la forma de vida más difundida en la naturaleza. Su presencia tiene efectos positivos y negativos para la vida del hombre, consecuentemente su control es fundamental para evitar que esos efectos produzcan consecuencias indeseables, para la salud, el medio ambiente y los bienes que hacen a la calidad de vida del ser humano. El mencionado control se puede realizar por medios físicos o químicos, los cuales deben ser específicos para la acción deseada y no deben producir efectos colaterales indeseados. El presente Reglamento tiene como misión ser el documento que integre los objetivos, alcance, clasificación, limitaciones y controles a ser efectuados sobre los productos químicos y procesos destinados al control de los microorganismos en el hábitat del ser humano. CAPITULO I DE ORDEN GENERAL 1. OBJETIVO El presente Reglamento Técnico tiene como objetivo definir, clasificar y reglamentar las condiciones para el registro y rotulado de los productos con acción antimicrobiana a ser comercializados. 2. ALCANCE Este Reglamento comprende los productos con acción antimicrobiana destinados al uso en objetos, sobre superficies inanimadas, y ambientes, en el hogar, en las industrias, en los hospitales, establecimientos relacionados con la atención de la salud y en locales o establecimientos públicos o privados. 3. DEFINICIONES/GLOSARIO 3.1 Desinfectante: Es un producto que mata todos los microorganismos patógenos pero no necesariamente todas las formas microbianas esporuladas en objetos y superficies inanimados. (Res. GMC N° 26/96). 3.2 Sanitizante: Es el agente/producto que reduce el número de bacterias a niveles seguros de acuerdo a normas de salud. (Res. GMC N° 26/96). 3.3 Desodorizante: Producto que tiene en su composición sustancias con actividad antimicrobiana, capaz de controlar olores desagradables. (Res. GMC N° 26/96). 3.4 Fungicida: Es un producto letal para todas las formas de hongos (Res. GMC N° 26/96). 3.5 Germicida: Es un producto de acción letal sobre los microorganismos, especialmente los patógenos (gérmenes) (Res. GMC N° 26/96). 3.6 Producto de uso institucional: Producto destinado a la venta y utilización bajo responsabilidad de persona jurídica, no siendo necesaria la aplicación por persona/entidad especializada. 3.7 Producto de uso profesional: Producto que por su riesgo o uso específico debe ser aplicado/ manipulado exclusivamente por persona capacitada. 3.8 Superficies fijas: Aquellas de gran extensión, tales como pisos, paredes, mobiliarios, etc. 3.9 Sufijo "cida": Indica que la acción antimicrobiana es la muerte de los microorganismos a los que se refiere, por ejemplo: germicida, microbicida, bactericida, fungicida, etc. 3.10 Sufijo "stático" / prefijo "anti": indica que la acción antimicrobiana se limita a la inhibición del crecimiento (multiplicación) del microorganismo sin llegar necesariamente a producirse la muerte del mismo, ejemplos: bacteriostático, fungistático, antibacteriano, etc. 3.11 Sustancia o Principio Activo: Componente que, en la formulación, es responsable de por lo menos una determinada acción del producto (Res. GMC N° 26/96). 3.12 Coadyuvante/Adyuvante: Componente complementario que mejora las propiedades del producto (Res. GMC N° 26/96). 3.13 Artículos no críticos: Objetos y equipamientos odontológicos, médicos y hospitalarios, que entran en contacto superficial con la piel intacta del organismo. 3.14 Embalaje: Envoltorio, recipiente o cualquier forma de acondicionamiento removible o no, destinado a cubrir, empaquetar, envasar, proteger o mantener específicamente o no, productos de los cuales trate este Reglamento. 3.15 Evaluación toxicológica: Estudio de los datos biológicos, bioquímicos y toxicológicos de una sustancia o de un producto por su acción en animales de laboratorio y otros sistemas de prueba, con el objetivo de extrapolar los resultados para la especie humana. 3.16 Producto formulado listo para su uso: Formulación que para su empleo no necesita de ningún procedimiento de dilución. 3.17 Producto técnico: Sustancia obtenida directamente de las materias primas, por un proceso de fabricación (químico, físico o biológico) cuya composición contiene porcentajes definidos de ingrediente activo, impurezas y aditivos. 3.18 Producto de uso doméstico: Son formulaciones de baja toxicidad y consideradas de uso seguro, de acuerdo con las recomendaciones de uso. 3.19 Rótulo: Identificación impresa y litografiada, así como también inscripciones pintadas o grabadas a fuego, presión o calco, aplicadas directamente sobre recipientes, envases y envoltorios. 4. CLASIFICACION POR AMBITO DE APLICACION 4.1 USO GENERAL: Productos para uso domiciliario y en ambientes públicos. 4.2 USO HOSPITALARIO: Productos para uso exclusivo en hospitales y establecimientos relacionados con la atención de la salud. 4.3 USO EN LA INDUSTRIA ALIMENTARIA Y AFINES: Productos destinados a ser utilizados en locales dedicados a producción/elaboración, fraccionamiento o manipulación de alimentos. 4.4 USO ESPECIFICO: Productos destinados a ser utilizados con el fin específico según las indicaciones del rótulo. 5 CONSIDERACIONES GENERALES 5.1 A los fines de la solicitud para registro de un producto domisanitario con acción antimicrobiana se deberán presentar los datos que constan en el Anexo I de este Reglamento. 5.2 Solamente se permitirán como principios activos de productos con acción antimicrobiana, sustancias comprobadamente aceptadas por la EPA, FDA o Comunidad Europea. En el caso de sustancias activas que no atiendan a esta condición, se deben presentar los datos que figuran en el Anexo II. 5.2.1. Podrán existir productos con acción antimicrobiana formulados con sustancias o mezcla de sustancias que no se clasifican individualmente como principios activos con actividad antimicrobiana, desde que proporcionen la acción deseada. 5.2.2 No se permitirán en las formulaciones sustancias que sean comprobadamente carcinogénicas, mutagénicas y teratogénicas para el hombre, según la Agencia Internacional de Investigación sobre el Cáncer (IARC/OMS). 5.3 Las condiciones de rotulado de los productos con acción antimicrobiana figuran en el Anexo III. 5.4 Los productos con acción antimicrobiana solamente serán registrados y autorizados para su uso mediante la comprobación de su eficacia para los fines propuestos, a través de análisis previos realizados al producto final en las diluciones y condiciones de uso indicados. 5.5 Los productos con acción antimicrobiana deberán comprobar su eficacia mediante la metodología de la AOAC - Association of Official Analytical Chemists o métodos adoptados por el CEN - Comité Europeo de Normatización. Cuando no existan métodos de las instituciones citadas, de la Autoridad Sanitaria competente de cada Estado Parte analizará caso a caso los métodos presentados. 5.6 Los microorganismos empleados para la evaluación de la actividad antimicrobiana constan en el Anexo V. 5.7 Los envases y tapas de los productos con acción antimicrobiana deben ser en todas sus partes resistentes a fines de mantener las propiedades del producto e impedir rupturas y pérdidas durante el transporte y manipulación. 5.7.1 No se permitirán envases de vidrio para uso doméstico, quedando al encargo de la Autoridad Sanitaria competente analizar la posibilidad de la utilización de las mismas para otras destinaciones. 5.7.2 Los productos de uso doméstico podrán contener un volumen máximo de 5 (cinco) kg/litros. 5.8. Se permitirán asociaciones de limpiadores con sanitizantes/desinfectantes. 5.9 Los productos con acción antimicrobiana deberán tener Dosis Letal 50, por vía oral, para ratones blancos machos, superior a 2.000 mg/kg de peso corpóreo para productos en forma líquida o superior a 500 mg/kg de peso corpóreo para productos en forma sólida. Se permitirá el cálculo teórico de DL50 oral. CAPITULO II PRODUCTOS CON ACCION ANTIMICROBIANA DE USO GENERAL 1. ALCANCE Este capítulo abarca los productos con acción antimicrobiana de uso doméstico, institucional o industrial, destinados a ser aplicados sobre objetos, superficies inanimadas y ambientes. 2. CLASIFICACION 2.1 Desodorizantes 2.2 Sanitizantes 2.3 Desinfectantes 3. LIMITACION POR TIPO Y AMBITO DE APLICACION 3.1 Productos destinados exclusivamente a la desodorización/sanitización/desinfección de pisos, paredes, mobiliarios y otras superficies, ambientes, sanitarios y utensilios que no entren en contacto con alimentos. CAPITULO III PRODUCTOS CON ACCION ANTIMICROBIANA PARA LA INDUSTRIA ALIMENTICIA Y AFINES 1. ALCANCE Este capítulo abarca los productos para uso en objetos, equipamientos y superficies inanimadas y ambientes donde se prepara, consume y almacena productos alimenticios utilizados en cocinas, industrias alimenticias, lácteas, frigoríficos, restaurantes y demás locales productores o manipuladores de alimentos. 2. CLASIFICACION 2.1 Sanitizantes 2.2 Desinfectantes 3. LIMITACION POR TIPO Y AMBITO DE APLICACION Productos destinados exclusivamente a la sanitización/desinfección de superficies y equipamientos que entran en contacto con el alimento. 4. LISTA DE SUSTANCIAS ACTIVAS PERMITIDAS Solamente se permitirá las sustancias constantes de la lista del Code of Federal Regulation N° 21 párrafo 178.1010 y las de la Directiva N° 98/8/CE, obedeciendo las respectivas restricciones y sus actualizaciones. 5. CONSIDERACIONES ESPECIFICAS PARA ROTULADO En las instrucciones de uso contenidas en el rótulo de los productos alcanzados en este capítulo deberá constar la indicación de enjuague o no, dependiendo del caso. CAPITULO IV PRODUCTOS DE ACCION ANTIMICROBIANA DE USO HOSPITALARIO 1. ALCANCE Este capítulo alcanza los productos para uso en ambientes, pisos, paredes, mobiliarios y artículos objetos, equipamientos y accesorios) utilizados exclusivamente en hospitales y establecimientos relacionados con la atención de la salud. 2. CLASIFICACION 2.1 Desinfectante hospitalario para superficies fijas y artículos no críticos. 3. LISTA DE SUSTANCIAS ACTIVAS NO PERMITIDAS No se permitirán en las composiciones de Desinfectantes hospitalarios para superficies fijas de los siguientes principios activos: • Formaldehído • Paraformaldeído • Glutaraldeído • Glioxal CAPITULO V PRODUCTOS CON ACCION ANTIMICROBIANA DE USO ESPECIFICO 1. ALCANCE Este capítulo alcanza los productos que, en función de su uso específico, no se encuadran en las clasificaciones contenidas en los capítulos anteriores de este Reglamento. 2. CLASIFICACION 2.1 Desinfectante para lactarios 2.2 Desinfectante para piscinas 2.3 Desinfectante para agua para consumo humano 2.4 Sanitizante/Desinfectante para tejidos y ropas 2.5 Sanitizante/Desinfectante para ropas hospitalarias 2.6 Otros 3. LIMITACION POR TIPO Y AMBITO DE APLICACION 3.1 Desinfectante para lactarios - producto destinado a la desinfección de utensilios que entran en contacto con la cavidad bucal del recién nacido y bebés, asegurando la destrucción de gérmenes patogénicos. Solamente podrán utilizarse como principios activos sustancias inorgánicas liberadoras de cloro activo e hipocloritos de sodio, litio o calcio. 3.2 Desinfectante para agua para consumo humano - producto destinado a destruir los gérmenes patogénicos y mantener una barrera de protección en aguas destinadas al consumo humano, obedeciendo los patrones referentes a niveles de metales pesados, componentes orgánicos y otras impurezas que comprometan a la salud de la población según normas vigentes de cada Estado Parte. Se podrán utilizar como principios activos sustancias orgánicas e inorgánicas liberadoras de cloro activo. Para el uso de otras sustancias activas deberá acompañarse de datos toxicológicos y otros que comprueben la seguridad de la misma en función de la finalidad de uso propuesto y de la salud humana. 3.3 Desinfectante para piscinas - producto empleado con finalidad higiénica y estética para evitar la transmisión de enfermedades contagiosas en aguas de piscina. Se podrán utilizar como principios activos sustancias orgánicas e inorgánicas liberadoras de cloro activo, sales de cuaternario de amonio y monopersulfato de potasio. Para el uso de otras sustancias activas deberá acompañarse de datos toxicológicos y otros que comprueben la seguridad de la misma en función de la finalidad de uso propuesto y de la salud humana. 3.4 Sanitizante/Desinfectante para tejidos y ropas - producto destinado a la eliminación o reducción de microorganismos en tejidos y ropas, pudiendo ser utilizado para pre-tratamiento o para el empleo durante el ciclo de lavado. 3.5 Sanitizante/Desinfectante para ropas hospitalarias - producto destinado a la eliminación o reducción de microorganismos en ropas utilizadas en hospitales y establecimientos relacionados a la salud, pudiendo ser utilizado para pre-tratamiento o para el empleo durante del ciclo de lavado. ANEXO I Requisitos para el registro de productos con acción antimicrobiana 1. Nombre del detentor del registro. 2. Dirección y teléfono comercial. 3. Número de Habilitación/Autorización del establecimiento fabricante o del que corresponda. 4. Nombre del Responsable Técnico. 5. Denominación genérica del producto. 6. Nombre/Marca. 7. Forma física y tipo de presentación. 8. Fórmula completa indicando los principios activos y demás componentes relacionados por los nombres técnicos o químicos en porcentaje p/p, p/v o v/v. 9. Nombre químico, común o genérico de las materias primas y número CAS. 10. Especificaciones físico-químicas, información técnica y de seguridad y contenido de posibles impurezas cuando las hubiere en los principios activos. 11. Metodología de análisis del producto terminado. 12. Plazo de validez propuesto para el producto evaluado por datos de estabilidad. 13. Breve descripción del método de producción. 14. Categoría/clase de uso. 15. Instrucciones de uso. 16. Descripción del envase primario/secundario (cuando exista y si corresponde). 17. Descripción del sistema de identificación del lote o partida. 18. Características físico químicas del producto. 19. Modelo de rótulo del envase primario y secundario (si corresponde). 20. Resultado/laudo de análisis químico y de eficacia microbiológica del producto de acuerdo con el uso propuesto. 21. Condiciones de almacenamiento. ANEXO II Datos necesarios para evaluación de nuevos principios activos 1. Toxidad aguda por vía oral para ratones, con valores de DL50 y descripción de los síntomas observados; 2. Toxidad aguda por vía dérmica para ratones, con valores de DL50 y descripción de los síntomas observados; 3. Toxidad aguda por vía inhalatoria para ratones, con valores de CL50 y descripción de los síntomas observados; 4. Test de irritación dérmica y ocular considerando los criterios establecidos en las respectivas metodologías internacionales para realización de los ensayos; 5. Test de sensibilidad dérmica en cobayos; 6. Test para verificación de mutagenicidad "in vitro" e "in vivo"; 7. Test para evaluación del metabolismo y excreción en ratones; 8. Test para verificación de efectos teratogénicos en ratones y conejos; 9. Test para verificación de efectos carcinogénicos en dos especies, siendo una de preferencia no roedora; 10. Test para verificación de efectos nocivos al proceso reproductivo en ratones, por lo mínimo en 2 generaciones. Dependiendo del caso, el órgano competente podrá solicitar algunos de los datos abajo relacionados: • Test de toxidad con dosis repetidas diarias por vía oral, dérmica e inhalatoria, (14/21/28 días) en lauchas, conejos y ratones; • Test de toxidad subcrónica (noventa días) por vía oral, dérmica e inhalatoria en lauchas, conejos y ratones. ANEXO III Rotulado de productos con acción antimicrobiana Además de atender la Resolución GMC N° 27/96, los productos con acción antimicrobiana deberán incluir en el rótulo: 1. Clasificación: en el panel principal junto al nombre del producto 2. Frases relacionadas con el riesgo, frases de advertencias y de primeros auxilios indicadas en el Anexo IV 3. Restricciones de uso (cuando corresponda) 4. Instrucciones de uso: en el panel principal o en el panel secundario 5. Dilución de uso: si corresponde, debe ser expresada en porcentaje, relación producto/diluyente o sus equivalentes en el Sistema Métrico Decimal 6. Tiempo de contacto: Según el uso propuesto 7. Limitaciones de uso: de acuerdo a las características de la formulación. 8. "ANTES DE USAR LEA LAS INSTRUCCIONES DEL ROTULO"; frase obligatoria para todos los productos comprendidos en este Reglamento en el panel principal, en destaque. 9. Principios activos: nombres químicos o técnicos con sus respectivas concentraciones en el panel principal del producto o en el secundario. 10. Número de Registro con la sigla de la Autoridad competente. 11. La mención o no en el rótulo del producto del nombre del Responsable Técnico en el Estado Parte receptor, deberá respetar las exigencias legales previstas en el mencionado Estado Parte. ANEXO IV Frases obligatorias para los productos con acción antimicrobiana A) En todos los rótulos de los productos con acción antimicrobiana deberán constar las siguientes frases: 1. "CUIDADO! Irritante para los ojos, piel y mucosa." - esta frase puede ser omitida si fuese comprobado que el producto se encuadra en la clasificación dérmica y ocular primaria como "no irritante" o "levemente irritante", de acuerdo con el test de Draize en conejos albinos o a través de ensayos in vitro debidamente evaluados y aceptados por la Autoridad Sanitaria competente. Esta frase debe constar en el panel principal. 2. "No mezclar con otros productos" a menos que lo indique el fabricante. 3. "Usar guantes para su aplicación." - esta frase puede ser omitida si fuese comprobado que el producto se encuadra en la clasificación dérmica primaria como "no irritante" o "levemente irritante", de acuerdo con el test de Draize en conejos albinos o a través de ensayos in vitro debidamente evaluados y aceptados por la Autoridad Sanitaria competente. 4. "No utilizar para desinfección de alimentos." Cuando fuera el caso. 5. "No ingerir." 6. Para productos en spray y aerosoles 6.1. "No aplicar sobre personas, alimentos y animales." 6.2. "No perforar el envase." 6.3. "No aplicar cerca del fuego." 6.4. "Prohibido reutilizar el envase." 6.5. "No exponer a temperatura superior a 50°C." 7. "Mantener fuera del alcance de los niños y animales domésticos." (en destaque) 8. "Mantener el producto en su embalaje original." 9. "No reutilizar los embalajes." B) Frases de primeros auxilios: 1. "En caso de contacto con los ojos y piel, lavar con agua en abundancia durante 15 minutos. Si la irritación persiste, consulte un médico llevando el envase o el rótulo del producto." 2. "En caso de ingestión accidental, no inducir el vómito. Consulte un médico inmediatamente, llevando el envase o el rótulo del producto." C) Para productos con acción antimicrobianas que sean cáusticos/corrosivos, deben ser agregadas las siguientes frases: 1. "PELIGRO! Causa daños si es ingerido." o "PELIGRO! Puede ser fatal si es ingerido." y/o "PELIGRO! Puede ser fatal si es inhalado o adsorbido por la piel." (según el caso). Esta frase deberá constar en el panel principal. 2. "CORROSIVO! / CAUSTICO! Causa quemaduras graves en contacto con los ojos, piel y mucosas." Esta frase deberá constar en el panel principal. 3. "Usar equipamientos de protección adecuados, tales como guantes, anteojos de protección, delantal, etc..." 4. "No comer, beber o fumar durante la aplicación." ANEXO V Microorganismos para Evaluación de la Actividad Antimicrobiana
|
||||||||
|
-o- |